题目内容
3.不能用金属跟氯气直接反应制取的氯化物是( )| A. | ZnCl2 | B. | CuCl2 | C. | FeCl2 | D. | NaCl |
分析 氯气具有强氧化性,能把变价金属氧化成最高价化合物,据此分析解答.
解答 解:Cl2有强氧化性,与金属反应化合生成相应的盐(氯化物),当与变价金属反应时将金属氧化成高价态,锌、钠是定价元素,铜是变价元素,和氯气反应生成氯化铜,故A、B、D正确,与Fe反应生成FeCl3,FeCl2不能用金属跟氯气直接反应制取,故C错误.
故选C.
点评 本题考查了物质性质,主要是氯气具有强氧化性,能把变价金属氧化生成最高价氧化物,常见的强氧化剂有:氯气、次氯酸、硝酸、氧气、高锰酸钾等,题目较简单.

练习册系列答案
相关题目
13.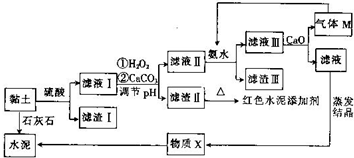 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
(1)为提高酸浸速率,除适当增大硫酸浓度外,还可采取的措施有搅拌、适当升温或将研磨黏土(任写一条).
(2)向滤液Ⅰ中加入H2O2的作用是将滤液中的Fe2+氧化为Fe3+;用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去.
(3)红色水泥添加剂的主要成分是Fe2O3.
(4)物质X的化学式为CaSO4•2H2O.
(5)气体M的电子式为 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
(2)向滤液Ⅰ中加入H2O2的作用是将滤液中的Fe2+氧化为Fe3+;用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去.
(3)红色水泥添加剂的主要成分是Fe2O3.
(4)物质X的化学式为CaSO4•2H2O.
(5)气体M的电子式为
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
14.北京和张家口市联合申办2022年冬奥会,目前北京市政府正在全力改善空气质量.以下不在空气质量报告范围内的是( )
| A. | 二氧化硫(SO2) | B. | 总悬浮颗粒物(TSP) | C. | 二氧化氮(NO2) | D. | 二氧化碳(CO2) |
11.将等物质的量的下列物质露置于空气中,最后质量变化由小到达的顺序是( )
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3.
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3.
| A. | ⑤<④<③<①<② | B. | ②<①<③<④<⑤ | C. | ⑤<④<②=③<① | D. | ⑤<③<④<②<① |
18.下列物质中属于电解质的是( )
| A. | H2 | B. | Na2SO4 | C. | C2H5OH | D. | CO2 |
8.某物质灼烧时,焰色反应为黄色,下列判断中正确的是( )
| A. | 该物质一定是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 该物质一定是单质钠 | D. | 能确定是否含钾元素 |
15.将标准状况下33.6L HCl溶于水配成250mL溶液,现用此盐酸与19.5g锌粒反应制取氢气.试计算:(写出计算过程)
(1)此盐酸的物质的量浓度;
(2)若要使锌完全反应,则所需盐酸的最小体积.
(1)此盐酸的物质的量浓度;
(2)若要使锌完全反应,则所需盐酸的最小体积.
13.R2O8n-离子在一定条件下能把Mn2+氧化为MnO4-,若R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,有关叙述正确的是( )
| A. | n值为2 | |
| B. | 氧化产物与还原产物的物质的量比为2:5 | |
| C. | n值为3 | |
| D. | 氧化性R2O8n->MnO4- |