题目内容
13.R2O8n-离子在一定条件下能把Mn2+氧化为MnO4-,若R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,有关叙述正确的是( )| A. | n值为2 | |
| B. | 氧化产物与还原产物的物质的量比为2:5 | |
| C. | n值为3 | |
| D. | 氧化性R2O8n->MnO4- |
分析 先根据化合价的变化判断氧化剂和还原剂,然后根据原子守恒配平方程式,再根据电荷守恒判断n值以及氧化产物与还原产物的物质的量关系,以此解答该题.
解答 解:该反应中,锰元素的化合价变化为+2价→+7价,失电子化合价升高,锰离子作还原剂;氧元素的化合价不变,所以R元素得电子化合价降低,R2O8n-作氧化剂,即R2O8n-与Mn2+的物质的量之比为5:2,根据各元素的原子守恒写出并配平该方程式为8H2O+5R2O8n-+2Mn2+=2MnO4-+10RO42-+16H+,根据电荷守恒得-5n+2×2=-1×2+(-2×10)+1×16,解得:n=2,
由方程式可知氧化产物与还原产物的物质的量比为1:5,
反应中氧化剂氧化性大于氧化产物的氧化性,则有氧化性R2O8n->MnO4-,
故选AD.
点评 本题考查氧化还原反应的计算,根据原子守恒和电荷守恒即可分析解答本题,难度不大,侧重于考查学生对氧化还原反应的原理的应用能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
3.不能用金属跟氯气直接反应制取的氯化物是( )
| A. | ZnCl2 | B. | CuCl2 | C. | FeCl2 | D. | NaCl |
4.据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是( )
| A. | O4的摩尔质量是64 g | |
| B. | O4与O2互为同位素 | |
| C. | O4与O3、O2都是氧元素的同分异构体 | |
| D. | 相同质量的O4与O3所含原子个数之比为1:1 |
18.下列解释事实的方程式不准确的是( )
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ |
2.下列有关环境问题的叙述正确的是( )
| A. | 赤潮、白色污染、绿色食品都与相关物质的颜色有关 | |
| B. | 地震发生后,灾区急需大量消毒剂,其中SO2可用于环境消毒 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约能源,保护环境 | |
| D. | 电池一定要回收利用,主要是为了避免浪费 |
19.《常用危险化学用品贮存通则》规定:“遇火、遇热、遇潮能引起燃烧、爆炸或发生化学反应,产生有毒气体的化学危险品不得在露天或在潮湿、积水的建筑物中贮存”.下列解释事实的方程式中,不合理的是( )
| A. | 贮存液氮的钢瓶防止阳光直射:N2+O2$\frac{\underline{\;阳光\;}}{\;}$2NO | |
| B. | 硝酸铵遇热爆炸:2NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+O2↑+4H2O↑ | |
| C. | 干燥的 AlCl3遇水产生气体:AlCl3+3H2O═Al(OH)3+3HCl↑ | |
| D. | 火灾现场存有电石,禁用水灭火:CaC2→Ca(OH)2+C2H2↑ |
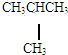
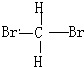 和
和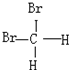 E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4
E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4