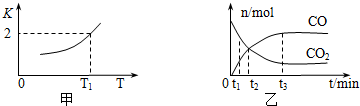
题目内容
16.除去Cl2中混有的水蒸气和氯化氢气体,可使气体依次通过盛有下列物质的洗气瓶( )| A. | 浓硫酸、水 | B. | 饱和食盐水、浓H2SO4 | ||
| C. | 烧碱、石灰水 | D. | 无水CaCl2、烧碱 |
分析 氯化氢易溶于水,氯气难溶液饱和实验水,利用浓硫酸干燥氯气,可吸收水,洗气可除杂,以此来解答.
解答 解:A.因为最后气体通过水,其中会混入水蒸气,故A错误;
B.饱和食盐水除去HCl(g),浓H2SO4除去水蒸气,故B正确;
C.烧碱、石灰水可与氯气反应,不能用于除杂,故C错误;
D.烧碱与氯气反应,不能用于除杂,故D错误.
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
7.下列关于仪器使用的方法正确的是( )
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 滴定管装滴定液前应先用该溶液润洗 | |
| C. | 分液漏斗和蒸馏烧瓶使用前都要检查是否漏液 | |
| D. | 配制溶液时,只要容量瓶的容积符合要求就可以直接使用 |
4.下列离子方程式书写正确的是( )
| A. | 氢氧化钠溶液中通入过量二氧化碳:OH-+CO2═HCO3- | |
| B. | 碳酸钙溶于稀醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 向碳酸氢铵稀溶液中加入过量烧碱溶液:NH4++OH-═NH3H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
11.中科院宁波材料所在金属空气电池的研发中获得重大突破.该电池的工作原理如图所示:

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| C. | 电池工作时,电流由M极经外电路流向N极 | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
1.巴伊亚祖母绿号称是世界上最大的祖母绿矿石,重380余公斤,含有约18万克拉的祖母绿宝石,价值约4亿美元.祖母绿的元素组成是O、Si、Al、Be,化学式为Be3Al2Si6O18.

(1)基态Al原子中,电子占据的最高能级的符号是3p,该能级具有的原子轨道数为3.
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图1),在1000℃,氯化铍则以BeCl2形式存在.在BeCl2分子中,Be的杂化方式为sp,二聚体Be2Cl4中Be的杂化方式为sp2,1mol Be2Cl4中含有2mol配位键.
(3)氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
乙酸分子中σ键与π键数目之比为7:1,由表格中的数据知,乙酸的熔沸点均比乙醇高,原因是乙酸中羧基上的两个O原则均可形成氢键,比乙醇形成分子间氢键的概率大.
(4)如图2所示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3,则晶胞参数a=0.38nm.

(1)基态Al原子中,电子占据的最高能级的符号是3p,该能级具有的原子轨道数为3.
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图1),在1000℃,氯化铍则以BeCl2形式存在.在BeCl2分子中,Be的杂化方式为sp,二聚体Be2Cl4中Be的杂化方式为sp2,1mol Be2Cl4中含有2mol配位键.
(3)氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
| 乙酸 | 乙醇 | |
| 熔点/℃ | 16.6 | -114.3 |
| 沸点/℃ | 117.9 | 78.4 |
(4)如图2所示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3,则晶胞参数a=0.38nm.
8.某可逆反应aA+bB?cC+Q在某温度下的平衡常数为K(K≠1),反应热为Q.保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
| A. | 写成2aA+2bB?2cC,Q值、K值均扩大了一倍 | |
| B. | 写成2aA+2bB?2cC,Q值扩大了一倍,K值保持不变 | |
| C. | 写成cC?aA+bB,Q值、K值变为原来的相反数 | |
| D. | 写成cC?aA+bB,Q值变为原来的相反数,K值变为倒数 |
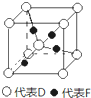 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子. .
.