题目内容
20.已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,达到平衡后:(1)要使HClO的浓度增大,可加入下列哪种物质(填代号)AB.
A.Cl2 B.NaHCO3 C.HCl D.NaOH
(2)由此说明在实验室里可用排饱和食盐水收集Cl2的理由是氯离子浓度大使平衡逆向移动,减小氯气的溶解.
分析 (1)根据平衡移动原理知,只要加入只和盐酸反应的物质就能使HClO浓度增加;
(2)饱和食盐水中氯离子浓度较大,氯离子抑制氯气和水反应.
解答 解:A.通入氯气,平衡正向移动,HClO浓度增大,故A正确;
B.NaHCO3+HCl=NaCl+H2O+CO2↑,HClO和NaHCO3不反应,所以平衡向正反应方向移动,则HClO浓度增加,故B正确;
C.加入HCl,溶液中氢离子浓度增大,抑制氯气和水反应,则HClO浓度降低,故C错误;
D.NaOH+HCl=NaCl+H2O、HClO+NaOH=NaClO+H2O,促进氯气和水反应,但溶液中HClO浓度降低,故D错误;
故答案为:AB;
(2)饱和食盐水中含有大量氯离子,氯离子抑制氯气和水反应,所以能使Cl2+H2O?HCl+HClO向逆反应方向移动,从而减小氯气的溶解,
故答案为:氯离子浓度大使平衡逆向移动,减小氯气的溶解.
点评 本题考查了弱电解质的电离,为高频考点,侧重考查学生的分析能力,明确弱电解质电离特点、物质的性质即可解答,(2)是实验室制取氯气时收集氯气的方法,明确其原理,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
5.下列热化学方程式正确的是(注:△H的数值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=+116.2kJ/mol(反应热) |
8.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表.
(1)反应前4min的平均速率v(CO2)=0.225 mol/(L.min)
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
15.某温度下,密闭容器中发生反应aX(g)?bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质X的浓度是原来的1.8倍.则下列叙述正确的是( )
| A. | 可逆反应的化学计量数数:a>b+c | |
| B. | 压缩容器的容积时,v正增大,v逆减小 | |
| C. | 达到新平衡时,Y,Z浓度增大,K值变大 | |
| D. | 达到新平衡时,加入物质X反应正动,X的转化率增大 |
5. 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A. | (a)甲>乙,(b)甲>乙 | B. | (a)甲>乙,(b)甲=乙 | C. | (a)甲<乙,(b)甲>乙 | D. | (a)甲>乙,(b)甲<乙 |
12.下列有关说法正确的是( )
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为△H=-285.8 kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2 H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
9.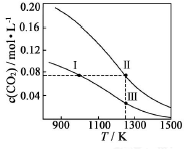 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
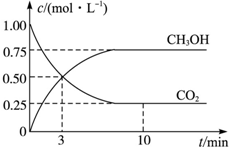 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.