题目内容
2.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.(2)如图1是一个电化学过程示意图.
①锌片上发生的电极反应是Cu2++2e-=Cu.
②假设使用Li-SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li-SOCl2电池理论上消耗Li的质量28g
(3)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图2所示:
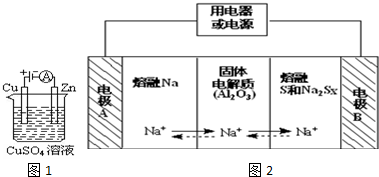
①放电时,电极A为负极.
②放电时,内电路中Na+的移动方向为从A到B(填写“从A到B”或“从B到A”).
③充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS.
分析 (1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)①电解池的阴极上是阳离子发生得电子的还原反应;
②根据转移电子数目相等,分析解答;
(3)原电池工作时,控制的温度应为满足Na、S为熔融状态,Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此解答.
解答 解:(1)16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ,32g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)①与电源负极相连的是电解池的阴极,在阴极上阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
②铜为阳极,发生氧化反应,铜片质量变化128g,转移电子的物质的量为$\frac{128g}{64g/mol}$×2=4mol,所以消耗Li的质量质量为4mol×7g/mol=28g,故答案为:28;
(3)①放电时,Na被氧化,应为原电池负极,故答案为:负;
②阳离子向正极移动,即从A到B,故答案为:从A到B;
③充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故答案为:Sx2--2e-=xS.
点评 本题是一道有关热化学和电化学知识的综合考察知识题目,侧重于学生的分析能力的考查,注意把握电解池的工作原理以及电极方程式的书写,答题时注意体会,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
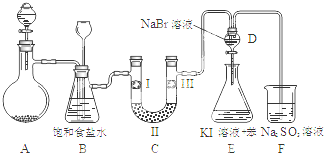
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d.
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为深棕红色,说明氯的非金属性大于溴.打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能说明溴的非金属性强于碘 (填“能”或“不能”),原因是过量的Cl2也可将I-氧化为I2.

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
10.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:下列叙述错误的是( )

| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与Na2CO3溶液反应 | |
| C. | Y分子中所有原子可能在同一平面上 | |
| D. | Z能发生加成反应、取代反应,但不能发生氧化反应 |
7.下列家庭化学小实验不能达到预期目的是( )
| A. | 用纯碱溶液洗涤沾有油污的器具 | |
| B. | 用食醋除去热水瓶胆中积存的水垢 | |
| C. | 用米汤检验加碘盐中含有碘 | |
| D. | 用灼烧并闻气味的方法区分化纤物质与纯毛织物 |
14.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
11.现有NO、NO2、O3三种气体,它们含有的氧原子数目相同,则三种气体的物质的量之比为( )
| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |

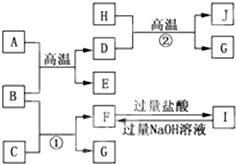 如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.
如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.