题目内容
4.用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液时,下列操作中不正确的是( )| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液 | |
| C. | 滴定时,应左手控制活塞,右手摇动锥形瓶,眼睛时刻注视着锥形瓶内颜色的变化 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
分析 A.根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
B.锥形瓶不需要润洗;
C.根据中和滴定操作和目光注视锥形瓶内颜色变化分析;
D.读数时,应该平视液面最低点.
解答 解:A.酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸,标准液的浓度减小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故A错误;
B.锥形瓶不需要润洗,所以锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液,故B正确;
C.滴定时,应左手控制活塞缓慢滴加,右手摇动锥形瓶使溶液混合均匀,眼睛时刻注视着锥形瓶内颜色的变化,以判断滴定终点,故C正确;
D.读数时,应该平视液面最低点,即视线与滴定管内液体的凹液面最低处保持一致,故D正确.
故选A.
点评 本题主要考查了中和滴定操作以及误差分析,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,注意把握中和滴定实验的操作规范,题目难度中等,侧重分析与实验能力的考查.

练习册系列答案
相关题目
19.在某合成氨厂的合成氨反应中,测得合成塔入口处气体N2、H2、NH3的体积比为6:18:1,出口处N2、H2、NH3的体积比为9:27:8,则N2的转化率为( )
| A. | 75% | B. | 50% | C. | 25% | D. | 20% |
16.下列反应可以制备MgO;MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2 (g);△H>0;在恒容条件下,达平衡后,增大(加入)x,重新平衡后,y也增大,符合此要求的组合是( )
| 选项 | A | B | C | D |
| x | 温度 | 压强 | SO2的浓度 | 加入催化剂 |
| y | 容器内气体密度 | CO2的体积分数 | 平衡常数 | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
13.a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)?2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变.在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
| A. | a1、a2均减小 | B. | a1减小,a2增大 | C. | a1、不变,a2增大 | D. | a1不变,a2减小 |
 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.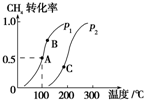 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
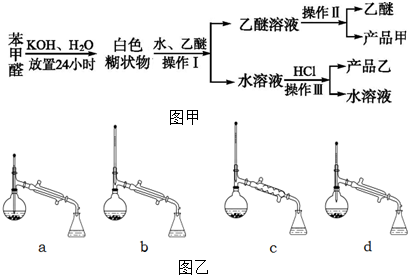
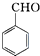 +KOH→
+KOH→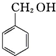 +
+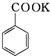
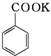 +HCl→
+HCl→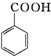 +KCl
+KCl