题目内容
7.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 常温常压下,1mol羟基含有的电子数为10NA | |
| B. | 将0.5molCl2通入水中,得到的溶液中含有的HClO分子数为0.5NA | |
| C. | 标准状况下,2.24LNO和1.12LO2充分反应,所得气体中原子数目一定为0.3NA | |
| D. | 0.1L1mol•L-1的NaClO溶液中含有的ClO-离子数为0.1NA |
分析 A.1个羟基含有9个电子;
B.氯气与水反应为可逆反应;
C.依据原子个数守恒判断;
D.次氯酸根离子为弱酸的酸式根离子,水溶液中部分水解.
解答 解:A.1个羟基含有9个电子,常温常压下,1mol羟基含有的电子数为9NA,故A错误;
B.氯气与水反应为可逆反应,可逆反应不能进行到底,所以将0.5molCl2通入水中,得到的溶液中含有的HClO分子数为0.5NA,故B错误;
C.标准状况下,2.24LNO物质的量为0.1mol,含有0.2mol原子,1.12LO2物质的量为0.05mol,含有原子个数为0.1mol,反应前后原子个数守恒,作用共含有原子个数0.3NA,故C正确;
D.次氯酸根离子为弱酸的酸式根离子,水溶液中部分水解,0.1L1mol•L-1的NaClO溶液中含有的ClO-离子数小于0.1NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,题目难度中等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,16 g O3所含的氧原子数目为NA | |
| B. | 1 mol•L-1CaCl2溶液中含有的Cl-数目为2NA | |
| C. | 5.6 g Fe与足量盐酸反应失去的电子数目为0.3NA | |
| D. | 标准状况下,22.4 L苯含有的分子数目为NA |
15.pH测定是检验物质的常用方法,下列有关pH测定的实验合理的是( )
| A. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 | |
| B. | 用pH试纸分别测定氯水和盐酸的pH值,比较两溶液的酸性强弱 | |
| C. | 取同体积不同浓度的醋酸和盐酸加水稀释相同倍数,测定稀释前后pH值的变化,以此区别这两种酸 | |
| D. | 测定硫酸型酸雨的pH值时,取样后应立即测定 |
2.常温下,下列说法不正确的是( )
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1mol•L-1的CH3COOH溶液中,由水电离的c(H+)为1×10-13mol•L-1 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后溶液的pH<7 | |
| D. | 等体积pH=2的H2SO4溶液和pH=2的CH3COOH溶液混合后溶液的pH=2 |
6.下列叙述正确的是( )
| A. | 硝酸具有还原性 | B. | 光导纤维的主要成分是二氧化硅 | ||
| C. | 次氯酸是一种强酸 | D. | 钠的焰色为浅紫色 |
7.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).


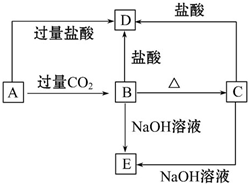 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.