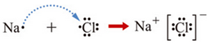题目内容
9. 气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系:
气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系:请回答下列问题:
(1)写出A的电子式:
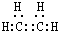 .
.(2)写出过程 ②的化学方程式:CH3COOCH2CH3+H2O$\stackrel{催化剂}{→}$CH3COOH+CH3CH2OH.
分析 石油裂解已成为生成A的主要方法,A在标准状况下的密度为1.25g•L-1,则A的相对分子质量为28,则A为CH2=CH2,D的分子式为C4H8O2,根据各物质转化关系可知,A、B、C、D中各含有两个碳原子,D在酸性条件下水解得到B和C,C的相对分子质量比B大14,则B比C少一个氧多两个氢,所以B为CH3CH2OH,C为CH3COOH,D为CH3COOCH2CH3,据此答题.
解答 解:石油裂解已成为生成A的主要方法,A在标准状况下的密度为1.25g•L-1,则A的相对分子质量为28,则A为CH2=CH2,D的分子式为C4H8O2,根据各物质转化关系可知,A、B、C、D中各含有两个碳原子,D在酸性条件下水解得到B和C,C的相对分子质量比B大14,则B比C少一个氧多两个氢,所以B为CH3CH2OH,C为CH3COOH,D为CH3COOCH2CH3,
(1)根据上面的分析可知,A为CH2=CH2,其电子式为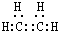 ,故答案为:
,故答案为: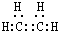 ;
;
(2)过程②的化学方程式为CH3COOCH2CH3+H2O$\stackrel{催化剂}{→}$CH3COOH+CH3CH2OH,故答案为:CH3COOCH2CH3+H2O$\stackrel{催化剂}{→}$CH3COOH+CH3CH2OH.
点评 本题考查有机物推断,涉及烯、醇、羧酸、酯的性质与转化等,难度不大,注意基础知识的理解掌握

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.化学与人类生产、生活、社会可持续发展密切相关.下列有关说法正确的是( )
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 | |
| D. | 向水中加入明矾进行杀菌消毒 |
20.表为元素周期表的一部分,请回答有关问题:
(1)分别写出⑤的单质和氧化物的一种用途Si作半导体材料,二氧化硅作光纤的材料.
(2)画出表中最活泼的金属阳离子的结构示意图是 ,
,
(3)比较②③⑦三种元素的离子半径大小Cl->F->Mg2+
(4)海水提溴的富集过程是用⑥的一种氧化物与⑩的单质稀溶液反应,达到富集提取的目的,写出该离子方程式SO2+Cl2+2H2O=4H++2Cl-+SO42-
(5)设计一简单实验,比较③和④两种元素金属性的强弱取相同大小的Mg、Al,分别与等浓度的盐酸反应.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 第4周期 | ⑨ | ⑩ |
(2)画出表中最活泼的金属阳离子的结构示意图是
 ,
,(3)比较②③⑦三种元素的离子半径大小Cl->F->Mg2+
(4)海水提溴的富集过程是用⑥的一种氧化物与⑩的单质稀溶液反应,达到富集提取的目的,写出该离子方程式SO2+Cl2+2H2O=4H++2Cl-+SO42-
(5)设计一简单实验,比较③和④两种元素金属性的强弱取相同大小的Mg、Al,分别与等浓度的盐酸反应.
4.实验室收集下列气体,不能用排空气法收集的是( )
| A. | H2 | B. | Cl2 | C. | NO | D. | SO2 |
18.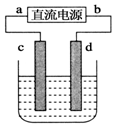 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )| A. | a是电源的正极 | B. | 电子流动的方向:d→b | ||
| C. | c极发生氧化反应 |