题目内容
4.一定温度下,反应N2(g)+O2(g)?2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
| A. | 恒容充入N2 | B. | 缩小体积使压强增大 | ||
| C. | 恒容充入氦气 | D. | 恒压充入氦气 |
分析 根据影响化学反应速率的因素有浓度、温度、压强和催化剂等进行判断,注意压强的改变必须是浓度改变时,反应速率才能发生改变,以此解答.
解答 解:A.恒容,充入N2,则增大氮气的浓度,可以加快该化学反应的速率,故A不选;
B.缩小体积使压强增大,则增大各组分浓度,可以加快该化学反应的速率,故B不选;
C.恒容,充入He,各组分浓度不变,速率不变,故C选;
D.恒压,充入He,体积增大,各组分浓度减小,速率减小,故D选.
故选C.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
14.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 春节期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
15.结合元素周期律,判断下列说法中正确的是( )
| A. | 核外电子层数越多的微粒半径一定较大 | |
| B. | 由5R-+RO-+6H+=3R+3H2O 判断,R元素可能是第ⅤA族元素 | |
| C. | 元素周期表对于生产和科研具有重要的指导意义,如半导体材料通常位于过渡元素区 | |
| D. | 既有非金属元素简单阴离子,又有非金属元素简单阳离子 |
12.元素性质周期性变化的根本原因是( )
| A. | 原子半径 | B. | 化合价 | ||
| C. | 金属性和非金属性 | D. | 原子核外电子结构 |
9.表是元素周期表的一部分,X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为1:3,则下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 原子半径大小为W>Z>Y>X | |
| B. | W的最高价含氧酸的酸性最强 | |
| C. | X、Z、Y、W的最髙正价分别为+4、+5、+6、+7 | |
| D. | Z与W形成的所有化合物中.原子最外层电子均达到8e-稳定结构 |
16.下列结论错误的是( )
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 微粒半径:K+>Al3+>S2->Cl- | |
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | |
| D. | 金属性:K>Ca>Mg>Be |
13.aX、bY、Z、W是四种原子序数依次增大的短周期主族元素,X、Y相邻且a+b=15,Z的最外层电子数是其最内层电子数的$\frac{1}{2}$,W形成的简单离子可表示为W2-,下列说法中正确的是( )
| A. | 最常见的氢化物的沸点:Y>X>W>Z | |
| B. | 简单离子半径:W>X>Y>Z | |
| C. | Y与Z能形成化学键类型完全相同的两种化合物 | |
| D. | Z与W形成的常见化合物溶于水后,水的电离程度变小 |
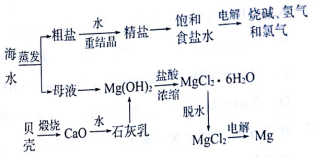
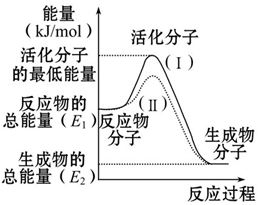 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题: