题目内容
海水中富含卤族元素.
(1)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-价层电子排布图为 .
(2)下列是部分金属元素的第一电离能
已知X、Y、Z 的价层电子构型为nS1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为 .
(3)CH3-CH2-Cl中与Cl原子成键的C以 杂化,而CH2=CH2-Cl中与Cl原子成键的C以 杂化.
(4)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近.则Cl2、IBr、ICl的沸点的由高到低的顺序为
(5)HClO4、HIO4、H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 .
(1)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-价层电子排布图为
(2)下列是部分金属元素的第一电离能
| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
(3)CH3-CH2-Cl中与Cl原子成键的C以
(4)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近.则Cl2、IBr、ICl的沸点的由高到低的顺序为
(5)HClO4、HIO4、H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为
考点:原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断,分子间作用力对物质的状态等方面的影响
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)氯离子核外有18个电子,3s、3p电子为其价电子;
(2)X、Y、Z的价层电子构型为ns1,则这三种元素都属于第IA族元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小,根据表格知,X、Y、Z这三种元素的金属性逐渐增强,原子半径逐渐增大,这三种金属的氯化物(RCl)都是离子晶体,离子晶体的熔点与离子半径成反比,与电荷数成正比;
(3)根据价层电子对互斥理论确定原子杂化方式;
(4)分子晶体中,物质的相对分子质量越大其熔沸点越高;
(5)含非羟基氧原子个数越多,酸性越强.
(2)X、Y、Z的价层电子构型为ns1,则这三种元素都属于第IA族元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小,根据表格知,X、Y、Z这三种元素的金属性逐渐增强,原子半径逐渐增大,这三种金属的氯化物(RCl)都是离子晶体,离子晶体的熔点与离子半径成反比,与电荷数成正比;
(3)根据价层电子对互斥理论确定原子杂化方式;
(4)分子晶体中,物质的相对分子质量越大其熔沸点越高;
(5)含非羟基氧原子个数越多,酸性越强.
解答:
解:(1)氯离子核外有18个电子,3s、3p电子为其价电子,其价电子排布图为 ,故答案为:
,故答案为: ;
;
(2)X、Y、Z的价层电子构型为ns1,则这三种元素都属于第IA族元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小,根据表格知,X、Y、Z这三种元素的金属性逐渐增强,原子半径逐渐增大,这三种金属的氯化物(RCl)都是离子晶体,离子晶体的熔点与离子半径成反比,与电荷数成正比,X、Y、Z这三种阳离子电荷数相等,离子半径逐渐增大,所以其熔点从小到大的顺序是ZCl<YCl<XCl,故答案为:ZCl<YCl<XCl;
(3)CH3-CH2-Cl中与Cl原子成键的C含有4个σ键,以sp3杂化,而CH2=CH2-Cl中与Cl原子成键的C含有3个σ键,以sp2杂化,故答案为:sp3;sp2;
(4)分子晶体中,物质的相对分子质量越大其熔沸点越高,Cl2、ICl、IBr都是分子晶体,其相对分子质量从Cl2、ICl、IBr逐渐增大,所以其熔沸点从高到低顺序是IBr>ICl>Cl2,故答案为:IBr>ICl>Cl2;
(5)含非羟基氧原子个数越多,酸性越强,非羟基氧分别为3、3、1,但非金属性Cl>I,则酸性为HClO4>HIO4>H5IO6,故答案为:HClO4>HIO4>H5IO6.
 ,故答案为:
,故答案为: ;
;(2)X、Y、Z的价层电子构型为ns1,则这三种元素都属于第IA族元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小,根据表格知,X、Y、Z这三种元素的金属性逐渐增强,原子半径逐渐增大,这三种金属的氯化物(RCl)都是离子晶体,离子晶体的熔点与离子半径成反比,与电荷数成正比,X、Y、Z这三种阳离子电荷数相等,离子半径逐渐增大,所以其熔点从小到大的顺序是ZCl<YCl<XCl,故答案为:ZCl<YCl<XCl;
(3)CH3-CH2-Cl中与Cl原子成键的C含有4个σ键,以sp3杂化,而CH2=CH2-Cl中与Cl原子成键的C含有3个σ键,以sp2杂化,故答案为:sp3;sp2;
(4)分子晶体中,物质的相对分子质量越大其熔沸点越高,Cl2、ICl、IBr都是分子晶体,其相对分子质量从Cl2、ICl、IBr逐渐增大,所以其熔沸点从高到低顺序是IBr>ICl>Cl2,故答案为:IBr>ICl>Cl2;
(5)含非羟基氧原子个数越多,酸性越强,非羟基氧分别为3、3、1,但非金属性Cl>I,则酸性为HClO4>HIO4>H5IO6,故答案为:HClO4>HIO4>H5IO6.
点评:本题涉及酸性强弱比较、原子杂化方式判断、物质熔沸点高低判断等知识点,侧重物质结构和性质的考查,注意(5)中酸性强弱比较方法,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列叙述,正确的是( )
A、人们使用
| ||||
| B、科学家们在过渡元素中寻找催化剂 | ||||
| C、目前周期表中的所有元素都是科学家们从自然界发现的 | ||||
| D、只有主族元素同时由短周期元素和长周期元素共同构成 |
将3.22克Na2SO4?10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则加入水的质量为( )克.
| A、18 | B、36 |
| C、34.2 | D、37.8 |
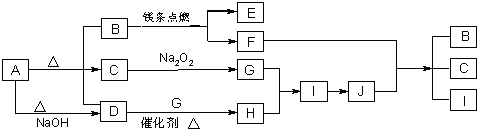
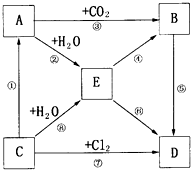 如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.