题目内容
10.某校化学兴趣小组为了探究原电池工作原理和钢铁的腐蚀与防护,进行如下系列实验.
(1)在相同条件下,①②③组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极电极反应式为O2+4e-+2H2O=4OH-;为防止金属Fe被腐蚀,可以采用上述③(填装置序号)装置原理进行防护,该方法的名称为外加电流阴极保护.
(2)装置④中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小.实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是60%(指参加原电池反应的锌占反应总量的百分率);装置⑤中如果Zn的消耗速率为1×10-3 mol/s,则K+的迁移速率为2×10-3mol/s.
(3)新型固体LiFePo4隔膜电池广泛应用于电动汽车.
电池反应为FePO4+Li$?_{充电}^{放电}$ LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电.该电池放电时Li+向正极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为FePO4+e-+Li+=LiFePO4.
分析 (1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;
(2)由于锌片和铜片都有铜析出,需要利用差量法进行计算反应消耗的锌的质量,再根据铜片质量增加的物质的量计算出参加原电池反应的锌的物质的量,最后计算出原电池工作效率;根据原电池工作中电流方向判断,钾离子与电流方向一致;根据电荷守恒判断钾离子流到速率;
(3)原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式.
解答 解:(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;①组装置中铁电极腐蚀最快;正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;②③装置中铁被保护,③为外加电流阴极保护,效果最好,故答案为:①;O2+4e-+2H2O=4OH-;③;外加电流阴极保护法;
(2)铜片、锌片表面均有红色物质铜析出,理解减小的质量为:3.94g-3.84g=0.1g,
根据反应关系式:Zn~Cu△m(减小)
65 64 1
6.5g 0.1g
参加反应的锌的质量为6.5g,
根据电子守恒,参加原电池反应的锌的物质的量为n(Zn)=n(Cu)=$\frac{3.84g}{64g/mol}$=0.06mol,该原电池的工作效率为:$\frac{0.06mol×65g/mol}{6.5g}$×100%=60%
铜为正极,锌为负极,电流在外电路有铜流向锌,溶液中电流由锌流向铜,所以钾离子流向硫酸铜溶液,氯离子流向硫酸锌溶液;根据电荷守恒可知,如果Zn的消耗速率为1×10-3mol/s,则钾离子则K+的迁移速率为2×10-3
故答案为:60%;2×10-3;
(3)FePO4+Li$?_{充电}^{放电}$LiFePO4 放电过程是原电池,总反应方程式减去负极反应得到正极电极反应:FePO4+Li++e-=LiFePO4;
故答案为:正;FePO4+Li++e-=LiFePO4.
点评 本题考查了金属腐蚀与防护的方法和应用,原电电解池电极反应书写应用,题目难度中等,书写电极反应式是解题的关键.

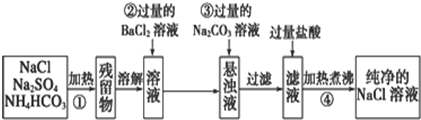
 实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).可供选择的液体试剂及固体药品:
| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、 碱石灰、Cu、Zn、Na2S |
(1)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→D→C←E←E←B.
(2)完成上述实验需选用仪器D和E,D中选用e,E中选用c、f(填写序号).
a.无水氯化钙 b.饱和碳酸氢钠溶液 c.饱和食盐水
d.五氧化二磷 e.碱石灰 f.浓硫酸
(3)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式3Cl2+8NH3=6NH4Cl+N2.
(4)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+.
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上有5个电子的X原子与原子核外N层上有5个电子的Y原子 | |
| C. | 2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |

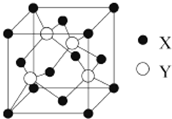 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
 .
. 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示: