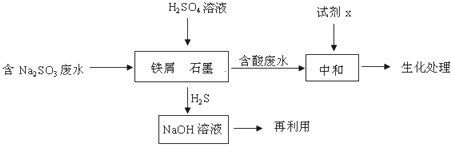
题目内容
2. 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
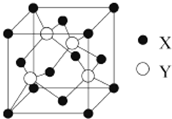
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.(1)X与Y所形成化合物晶体的晶胞如图所示.
①在1个晶胞中,X离子的数目为4.
②该化合物的化学式为ZnO.
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是sp3杂化.
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是水分子与乙醇分子之间形成氢键.
(4)Y与Z可形成YZ42-
①YZ42-的空间构型为正四面体(用文字描述).
②写出一种与YZ42-互为等电子体的分子的化学式:CCl4或SiCl4.
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为16NA.
分析 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
(1)根据均摊法计算晶胞中Zn、O原子数目,进而确定化学式;
(2)氢化物H2S分子中S原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4;
(3)水分子与乙醇分子之间形成氢键;
(4)①计算SO42-中S原子孤电子对数、价层电子对数确定其空间结构;
②原子数目相等、价电子总数相等的微粒互为等电子体;
(5)X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12molN-H、4mol配位键.
解答 解:元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
(1)①在一个晶胞中,X离子的数目8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:4;
②一个晶胞中,X离子的数目4,Y离子数目为4,该化合物的化学式为ZnO,
故答案为:4;ZnO;
(2)氢化物H2S分子中S原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4,故S原子采取sp3杂化,
故答案为:sp3杂化;
(3)水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,
故答案为:水分子与乙醇分子之间形成氢键;
(4)①SO42-中S原子孤电子对数为$\frac{6+2-2×4}{2}$=0,价层电子对数为4+0=4,故其空间结构为正四面体,
故答案为:正四面体;
②原子数目相等、价电子总数相等的微粒互为等电子体,一种与SO42-互为等电子体的分子的化学式:CCl4或SiCl4,
故答案为:CCl4或SiCl4;
(5)X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12molN-H、4mol配位键,故含有σ 键的数目为16NA,
故答案为:16NA.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、氢键、配合物、晶胞计算等,难度不大,元素推断是解题的关键,注意氢键对物质性质的影响.

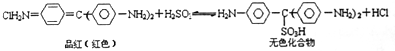
下列说法正确的是( )
| A. | 品红溶液中同时通入Cl2、SO2,漂白效果会更好 | |
| B. | 加热可判断品红褪色是通入SO2还是通入Cl2引起的 | |
| C. | “无色化合物”分子中,19个碳原子都可能在同一平面上 | |
| D. | 无色化合物中的官能团有苯环、磺酸基、氨基 |
| A. | 两元素必在同一周期 | B. | 两元素可能在相邻两周期 | ||
| C. | 两元素不可能同为金属元素 | D. | 两元素不可能同主族 |

| A. | 2 Ag(s)+Cd2+( aq)═2 Ag+(aq)+Cd(s) | B. | Co2+( aq)+Cd(s)═Co(s)+Cd2+( aq) | ||
| C. | 2 Ag+(aq)+Cd(s)═2Ag(s)+Cd2+( aq) | D. | 2Ag+( aq)+Co( s)═2 Ag(s)+Co2+( aq) |
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |

请填写下列空白:
(1)写出下列物质的化学式:BCl2,JNO.
(2)写出下列反应的离子方程式:
①H+E(溶液)→MH++ClO-═HClO.
②I溶于GNH3+H2O?NH3•H2O?NH4++OH-.
(3)在通常状况下,若1g C气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2mol H气体完全分解生成C气体和B气体的热化学方程式为2HCl(g)=H2(g)+Cl2(g)△H=+184.6kJ•mol-1.
| A. | 将盐卤或石膏加入豆浆中,制成豆腐 | |
| B. | 一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 | |
| C. | 三氯化铁溶液中滴稀氨水出现红褐色沉淀 | |
| D. | 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象 |
| A. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| B. | CH2=CH(CH3)C=CH2 2-甲基-1,3-二丁烯 | |
| C. | CH2(OH)CH2CH2CH2OH 1,4-二羟基丁醇 | |
| D. | CH3CH2CHClCCl2CH3 2,2,3-三氯戊烷 |