题目内容
19.下列有关实验设计或对实验原理的描述正确的是( )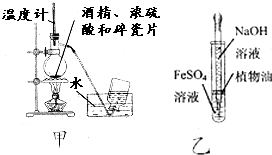
| A. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体 | |
| B. | 用甲图装置制取乙烯 | |
| C. | 用乙图装置制备少量氢氧化亚铁 | |
| D. | 加入适量乙醇和浓硫酸,加热,可除去乙酸乙酯中少量的乙酸 |
分析 A.瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应;
B.温度计用于测量混合液温度,应该插入溶液中;
C.植物油与将滴管伸入硫酸亚铁溶液中都可以减少与空气的接触,防止氢氧化亚铁被氧化;
D.乙酸与乙醇的酯化反应为可逆反应,不能得到纯净物.
解答 解:A.瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应而导致坩埚炸裂,故A错误;
B.制取乙烯时需要迅速加热到170℃,温度计用于测定混合液温度,所以温度计应该插入混合液中,故B错误;
C.氢氧化亚铁易被空气中氧气氧化,植物油与将滴管伸入硫酸亚铁溶液中都可以减少与空气的接触,防止氢氧化亚铁被氧化,故C正确;
D.乙酸与乙醇的酯化反应为可逆反应,不能得到纯净物,饮用饱和碳酸钠溶液除杂,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及物质的分离与提纯、乙烯的制取、氢氧化亚铁的制备等知识,明确化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
9.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A-D四个实验,你认为结论不正确的是( )
| A. | 在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,粉状的反应速率快 | |
| B. | 将相同大小、相同面积的镁条和铝条与相同浓度的盐酸反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
10.下列各选项中所描述的两个量,前者一定大于后者的是( )
| A. | 强酸和弱酸溶液的酸性 | |
| B. | 纯水在80℃和25℃的pH | |
| C. | 等物质的量的SO2和O2在一定条件下反应,两者的转化率 | |
| D. | 25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
7.复方蒿甲醚是目前国际上广泛认可的中国原创药品,它在疟疾这一高传染性疾病治疗史上具有里程碑的意义.该药品主要成分是青蒿素,结构如图.有关青蒿素的叙述中正确的是( )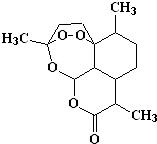

| A. | 青蒿素的化学式为C16H20O5 | |
| B. | 该有机物不能和NaOH溶液反应 | |
| C. | 青蒿素易溶于水 | |
| D. | 由于青蒿素中含有过氧键(-O-O-),具有较强的氧化性 |
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 含0.1molHCl溶液中含氢元素0.1NA | |
| B. | 22.4 L 水蒸气含原子数为3NA | |
| C. | 3.4g H2O2中含有的共用电子对数为0.1 NA | |
| D. | 标准状况下,1mol辛烷含有的氢原子数为18NA |
4.A与B在溶液中进行反应,无论A与B的物质的量之比如何,都可以用所示的离子方程式表示的是( )
| A. | 碘化钾与氯气:5I-+3Cl2-+3H2O→IO3-+6Cl-+6H+ | |
| B. | KAl(SO4)2与Ba(OH)2:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O | |
| C. | 氨水与SO2:NH3•H2O+SO2→HSO3-+NH4+ | |
| D. | NaAlO2与AlCl3:Al3++3AlO2-+6H2O→4Al (OH)3↓ |
11.仅能在水溶液中导电的电解质是( )
| A. | KOH | B. | KCl | C. | CO2 | D. | NH4HCO3 |
8.下列说法正确的是( )
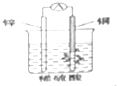

| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 右图原电池中,电流由锌棒经外电路流向铜棒 | |
| C. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
2.下列物质中只含有共价键的是( )
| A. | MgCl2 | B. | NH4C1 | C. | CO 2 | D. | NaOH |