题目内容
10.下列各选项中所描述的两个量,前者一定大于后者的是( )| A. | 强酸和弱酸溶液的酸性 | |
| B. | 纯水在80℃和25℃的pH | |
| C. | 等物质的量的SO2和O2在一定条件下反应,两者的转化率 | |
| D. | 25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
分析 A.溶液酸性强弱与氢离子浓度大小有关;
B.升温促进水的电离,氢离子浓度增大;
C.根据反应2SO2+O2?2SO3分析物质的量相等时而在的转化率大小;
D相同温度下.溶液的pH相等,则溶液中氢离子浓度相等.
解答 解:A.酸性强弱取决于氢离子浓度,强酸溶液中的氢离子浓度不一定等于弱酸,故A错误;
B.升温促进水的电离,氢离子浓度增大,纯水在80℃和25℃时的pH,前者小,故B错误;
C.发生反应为2SO2+O2?2SO3,则等物质的量的SO2和O2在一定条件下反应,消耗的SO2的物质的量是O2的2倍,所以SO2的转化率比O2大,故C正确;
D.25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度相等,故D错误;
故选C.
点评 本题考查较为综合,涉及酸性强弱比较、溶液pH计算、化学平衡计算等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握温度对水的电离的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.某同学在实验室进行以下实验,请将实验①②③的现象和离子反应方程式填入实验报告中.
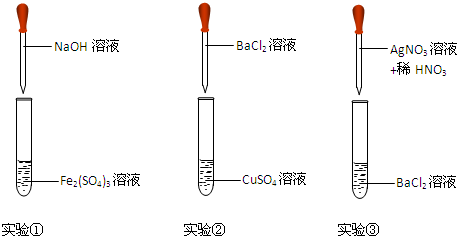

| 编号 | 现象 | 离子方程式 |
| ① | ||
| ② | ||
| ③ |
18. 科学家对石墨进行处理,使得石墨片的厚度逐渐减少,最终获得目前已知的最薄的材料--石墨烯(如图).下列关于石墨烯的说法正确的是( )
科学家对石墨进行处理,使得石墨片的厚度逐渐减少,最终获得目前已知的最薄的材料--石墨烯(如图).下列关于石墨烯的说法正确的是( )
 科学家对石墨进行处理,使得石墨片的厚度逐渐减少,最终获得目前已知的最薄的材料--石墨烯(如图).下列关于石墨烯的说法正确的是( )
科学家对石墨进行处理,使得石墨片的厚度逐渐减少,最终获得目前已知的最薄的材料--石墨烯(如图).下列关于石墨烯的说法正确的是( )| A. | 石墨烯是一新型的纳米化合物 | B. | 石墨烯与C60互为同素异形体 | ||
| C. | 石墨烯是一种有机物 | D. | 石墨烯中碳元素的化合价为+3 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,则NA个N2分子与足量氢气充分反应释放热量92.4kJ | |
| D. | Na2O2与CO2反应生成1 molO2时,转移的电子数为2NA |
19.下列有关实验设计或对实验原理的描述正确的是( )
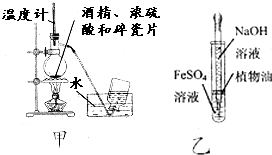

| A. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体 | |
| B. | 用甲图装置制取乙烯 | |
| C. | 用乙图装置制备少量氢氧化亚铁 | |
| D. | 加入适量乙醇和浓硫酸,加热,可除去乙酸乙酯中少量的乙酸 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.1mol乙烯和乙醇(蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为4NA | |
| D. | 120gNaHSO4固体中含有的离子总数为3NA |
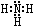 ;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为
;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为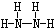 .若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.
.若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.