题目内容
20.下列说法正确的是( )| A. | 氧气的气体摩尔体积是22.4L | B. | 硫酸的摩尔质量是98g | ||
| C. | CO2的相对分子质量是44g | D. | CO32-摩尔质量是60g/mol |
分析 A.气体摩尔体积与温度、压强有关;
B.摩尔质量单位为g/mol;
C.相对分子质量单位为1;
D.摩尔质量单位为g/mol数值上等于相对分子质量.
解答 解:A.温度压强不确定,Vm不确定,故A错误;
B.硫酸的摩尔质量是98g/mol,故B错误;
C.CO2的相对分子质量是44,故C错误;
D.CO32-的相对分子质量为60,摩尔质量是60g/mol,故D正确;
故选:D.
点评 本题考查了物质的量、摩尔质量、气体摩尔体积等概念,明确相关量的概念及单位是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列离子方程式中,正确的是( )
| A. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 在CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入NaOH溶液中:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 氧化钠投入水中:O2-+H2O-═2OH- |
2.科学的实验方法为我们探索物质的世界提供了一把金钥匙,下列实验方法或操作正确的是( )
| A. | 两种互不相溶的液体,如汽油和水,可通过分液方法分离 | |
| B. | 因为碘易溶于酒精,所以常用酒精萃取碘水中的碘 | |
| C. | 观察钾元素焰色反应的操作:先将铂丝放在稀硫酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的外焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| D. | 将饱和FeCl3溶液滴入沸水中可得Fe(OH)3胶体,区别溶液和胶体的方法是丁达尔效应 | |
| E. | 分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体 | |
| F. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| G. | 为除粗盐中的可溶性杂质,先加氯化钡后加碳酸钠,最后加盐酸后过滤 | |
| H. | 在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
8.科学家刚刚发现了某种元素的原子,其一个原子的质量是a g,12C的一个原子的质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 该原子的摩尔质量是aNA | |
| B. | W克该原子的物质的量一定是$\frac{W}{a{N}_{A}}$ mol | |
| C. | W克该原子中含有$\frac{W}{b}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{a}$ |
15.下列有关实验操作说法中,正确的是( )
| A. | 用托盘天平称取5.85gNaCl | |
| B. | 用广泛pH试纸测得橙汁pH为3.50 | |
| C. | 用酸式滴定管量取25.00 mL高锰酸钾溶液 | |
| D. | 用酸性高锰酸钾溶液检验FeCl3中是否含有FeC12 |
5.下列离子方程式正确的是( )
| A. | 硫酸氢钠溶液和过量的Ba(OH)2溶液反应SO42-+H++Ba2++OH-=BaSO4↓+H2O | |
| B. | 碳酸氢钠水解:HCO3-+H2O=CO32-+H3O+ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 用铂电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
12.化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.化学用语具有简便、确切地表达化学知识和化学科学思维的特点.下列化学用语中,书写错误的是( )
| A. | 过氧化钠的电子式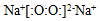 | |
| B. | CO2的电子式: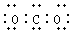 | |
| C. | ${\;}_{53}^{127}$I和${\;}_{53}^{129}$I2互为同位素 | |
| D. | 硫离子的结构示意图: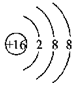 |
10.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 合成NH3反应,为提高NH3的产率,理论上应采取相对较低的温度 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 对于CO(g)+NO2(g)?CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深 | |
| D. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
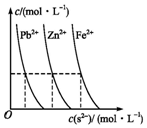 平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.
平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等.