题目内容
13.把5.1g铝镁合金的粉末放入100mL某盐酸中,恰好完全反应得到5.6L H2(标准状况下).试计算:(1)该盐酸的物质的量浓度;
(2)该合金中铝的质量分数(结果精确到0.1%).
分析 镁铝合金与盐酸发生反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,生成氢气的物质的量为:n(H2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,结合反应的方程式列方程式计算出盐酸的物质的量浓度、合金中铝的质量分数.
解答 解:标况下5.6L氢气的物质的量为0.25mol,设5.1g镁铝合金中含有镁xmol,含有铝ymol,则
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y $\frac{3}{2}$y
$\left\{\begin{array}{l}{x+\frac{3}{2}y=0.25}\\{24x+27y=5.1}\end{array}\right.$
解得:$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$
(1)反应消耗的盐酸的总物质的量为:0.1mol×2+0.1mol×3=0.5mol,
盐酸的物质的量浓度为:c(HCl)=$\frac{0.5mol}{0.1L}$=5mol/L,
答:该盐酸的物质的量浓度为5mol/L;
(2)该合金中铝的质量分数为:w(Al)=$\frac{27g/mol×0.1mol}{5.1g}$×100%≈52.9%,
故:该合金中铝的质量分数为52.9%.
点评 本题考查了有关混合物的计算,题目难度中等,注意掌握金属镁、铝与酸反应的化学方程式,能够根据题中数据计算出合金中各组分含量,试题培养了学生的分析、理解能力及计算能力.

 名校课堂系列答案
名校课堂系列答案| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
(2)30min后,只改变某一条件,根据上表的数据判断改变的条件可能是BC(双选)
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(3)若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低 (填“升高”或“降低”),△H<0(填“>”或“<”).
①H++Z-+XO42-→X2++Z2+H2O(未配平),
②2M2++R2═2M3++2R-
③2R-+Z2═R2+2Z-.
由此判断下列说法正确的是( )
| A. | 氧化性强弱顺序为XO42->Z2>R2>M3+ | |
| B. | Z2在③中发生氧化反应 | |
| C. | R元素在反应②中被氧化,在③中被还原 | |
| D. | 常温下反应不可进行2M2++Z2═2M3++2Z- |
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | NaOH晶体中既含有离子键又含有共价键 | |
| D. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
| A. | 水和四氯化碳可以用分液漏斗进行分离 | |
| B. | 提取溴水中的溴单质,可以用四氯化碳进行萃取 | |
| C. | 可以用高温加热的方法除去CaO中混有的CaCO3 | |
| D. | 可以用蒸发结晶的方法除去KNO3固体中混有的少量NaCl |
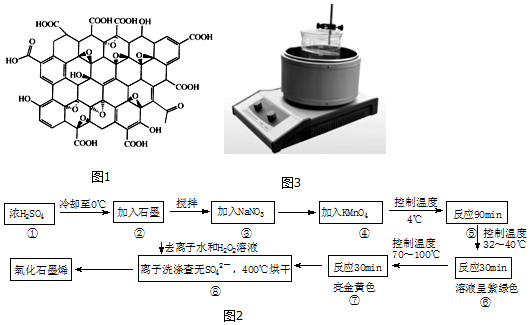
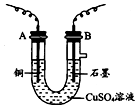 某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.