题目内容
3.在10L的一密闭容器中,用2mol的A和2mol的B发生:A(g)+2B(g)?2C(g),一小时后反应达到平衡,若此时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为40%,B在的反应速率0.16mol/(L•h),平衡时C的体积分数为50%.分析 设参加反应的A的物质的量为xmol,
A(g)+2B(g)?2C(g),
开始(mol)2 2 0
反应(mol)x 2x 2x
平衡(mol)2-x 2-2x 2x
若混合气体中A、B的物质的量之和等于C的物质的量,即2-x+2-2x=2x,据此计算x值;
A的转化率=$\frac{参加反应的n(A)}{反应初始n(A)}$×100%;
v(B)=$\frac{\frac{△n}{V}}{△t}$;
相同条件下气体的摩尔体积相同,所以平衡时C的体积分数等于其物质的量分数.
解答 解:设参加反应的A的物质的量为xmol,
A(g)+2B(g)?2C(g),
开始(mol)2 2 0
反应(mol)x 2x 2x
平衡(mol)2-x 2-2x 2x
若混合气体中A、B的物质的量之和等于C的物质的量,即2-x+2-2x=2x,x=0.8;
A的转化率=$\frac{参加反应的n(A)}{反应初始n(A)}$×100%=$\frac{0.8mol}{2mol}$×100%=40%;
v(B)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.8mol×2}{10L}}{1h}$=0.16 mol/(L•h);
相同条件下气体的摩尔体积相同,所以平衡时C的体积分数等于其物质的量分数=$\frac{0.8mol×2}{(2-0.8+2-1.6+1.6)mol}$×100%=50%,
故答案为:40%; 0.16 mol/(L•h);50%.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,利用“三段式”来分析解答即可,题目难度不大.

 综合自测系列答案
综合自测系列答案| A. | 还原剂中必定有元素化合价升高被氧化 | |
| B. | 通电后,氢氧化铁胶体向阴极运动 | |
| C. | 物质所含元素化合价升高的反应叫还原反应 | |
| D. | 胶体与其他分散系的本质区别是可以发生丁达尔效应 |
①2H2(g)+CO(g)?CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
(1)总合成反应的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol.
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是CE(填字母代号).
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表格:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
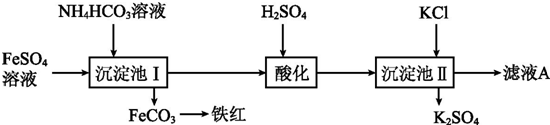
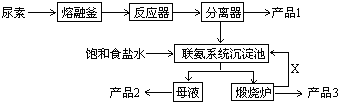
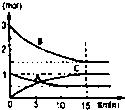 在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.
在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.