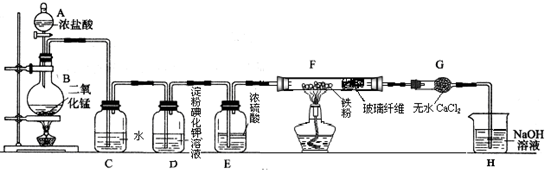
题目内容
5.含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化后逐一沉淀出来,其中B3+转入白色沉淀: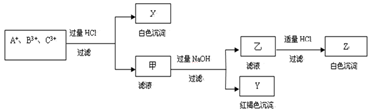
请通过分析回答(用化学符号填写):
(1)A+是Ag+,B3+是Al3+,C3+是Fe3+;
(2)X是AgCl,Y是Fe(OH)3,Z是Al(OH)3;
(3)写出下列离子方程式:
①生成Y沉淀:Fe3++3OH-═Fe(OH)3↓;②B3+与过量氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(4)写出下列化学方程式:单质铝和Y分解后的固体产物反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
分析 含有A+、B3+、C3+ 三种金属阳离子的水溶液,加入过量盐酸反应过滤得到白色沉淀X和滤液甲,白色沉淀只能是氯化银沉淀,说明A+离子为Ag+,滤液甲中加入过量氢氧化钠溶液过滤得到红褐色沉淀Y为Fe(OH)3,滤液乙中加入适量盐酸反应生成白色沉淀Z为Al(OH)3,其中B3+转入白色沉淀,则B3+、C3+ 离子分别为:Al3+、Fe3+,据此回答.
解答 解:含有A+、B3+、C3+ 三种金属阳离子的水溶液,加入过量盐酸反应过滤得到白色沉淀X和滤液甲,白色沉淀只能是氯化银沉淀,说明A+离子为Ag+,滤液甲中加入过量氢氧化钠溶液过滤得到红褐色沉淀Y为Fe(OH)3,滤液乙中加入适量盐酸反应生成白色沉淀Z为Al(OH)3,其中B3+转入白色沉淀,则B3+、C3+ 离子分别为:Al3+、Fe3+.
(1)上述分析可知A+、B3+、C3+ 三种金属阳离子分别为:Ag+、Al3+、Fe3+,
故答案为:Ag+;Al3+;Fe3+;
(2)分析可知对应X、Y、Z分别为:AgCl、Fe(OH)3、Al(OH)3,
故答案为:AgCl; Fe(OH)3;Al(OH)3;
(3)①生成Y沉淀的离子方程式为:Fe3++3OH-═Fe(OH)3↓,
故答案为:Fe3++3OH-═Fe(OH)3↓;
②Al3+与过量氨水反应生成氢氧化铝沉淀和铵根,离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(4)氢氧化铁分解产物是氧化铁,铝与氧化铁在高温下反应生成铁和氧化铝,放出大量的热,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2 Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2 Fe+Al2O3.
点评 本题考查物质分离提纯实验方案的设计,题目难度中等,注意掌握常见离子的反应现象及检验方法,明确氯化物中氯化银不溶于稀盐酸是解题关键.

| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
| A. | 提高风能、太阳能等可再生清洁能源的使用比例 | |
| B. | 推广CO2再利用技术,将其合成有价值的化学品 | |
| C. | 利用工业废水灌溉农作物,提高水资源的利用率 | |
| D. | 研发煤炭的洁净、高效利用技术,保护生态环境 |
| A. | 通入22.4LSO2参加反应时,有2 NA个电子发生转移 | |
| B. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| C. | 滴加KI溶液时,KI被氧化,CuI是氧化产物 | |
| D. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | NH3通入A1C13溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
| A. | 常温常压下,48 g O3中的氧原子数为3NA | |
| B. | 24 g金属镁变为镁离子时失去的电子数为NA | |
| C. | 4℃时9 mL水和标准状况下11.2 L氮气中的原子数均为NA | |
| D. | 2 mol•L-l的CuCl2溶液中含有的氯离子数为4NA |
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp | 2.8×10-9 | 9×10-6 |
②向上述悬浊液中加入足量Na2CO3固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④_______.
(1)步骤①所得悬浊液中c(Ca2+)=0.003 mol•L-1
(2)写出第②步发生反应的离子方程式:CO32-(aq)+CaSO4(s)=SO42-(aq)+CaCO3(s).
(3)请补充第④步操作及发生的现象加入盐酸,沉淀完全溶解,有气泡冒出.
(4)请写出该原理在实际生产生活中的一个应用用于除去锅垢: