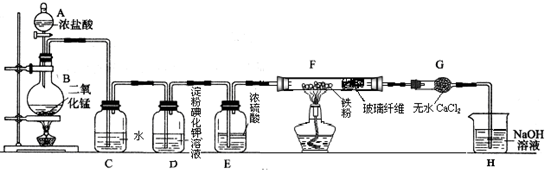
题目内容
2.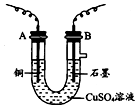 某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的正极 (填“正极”或“负极”),并写出B极发生反应的电极反应式4OH--4e-=O2↑+2H2O.
(2)电解开始一段时间后,在U形管中可观察到的现象铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅.
并写出该电解反应总的离子方程式2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+.
(3)实验中还需测定的数据是①(填写序号).
①A极的质量增重mg ②B极的质量增重mg
(4)铜的相对原子质量为:$\frac{11.2m}{V}$(用含有m、V的计算式表示).
(5)如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,放电时负极的电极反应式为CH4+10OH--8e-═CO32-+7H2O.
分析 (1)电解硫酸铜溶液,如果阳极上析出氧气,则阳极是惰性电极,工作时,阳极上氢氧根离子放电,阴极上铜离子放电,则阳极连接电源正极,阴极连接电源负极,根据两极上离子的放电顺序书写电极反应式;
(2)电解硫酸铜溶液,根据阴阳极上离子放电顺序书写电池反应式及溶液中出现的现象;
(3)要测定铜的相对原子质量还要测定析出铜的质量;
(4)根据铜的相对原子质量和氧气的关系式计算;
(5)甲烷燃料电池中,负极上甲烷失电子发生氧化反应.
解答 解:(1)若实验中测定在标准状况下放出的氧气的体积VL,说明阳极上是氢氧根离子放电而不是铜放电,所以铜作阴极,石墨作阳极,则A连接直流电源的负极,B连的是正极,是阳极,发生反应:4OH--4e-=O2↑+2H2O,
故答案为:正极;4OH--4e-=O2↑+2H2O;
(2)电解硫酸铜时,石墨作阳极,则阴极上铜离子得电子而析出铜,阳极上氢氧根离子放电而生成氧气,溶液中铜离子浓度减小,溶液颜色变浅,电池反应式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,
故答案为:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;
(3)要测定铜的相对原子质量还要测定析出铜的质量,A电极上析出铜,故选①;
(4)根据2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+知,标况下,生成22.4L氧气析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量=$\frac{22.4m}{2V}$=$\frac{11.2m}{V}$,故答案为:$\frac{11.2m}{V}$;
(5)甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查实验探究,难点是电极反应式的书写,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,如果燃料和氧化剂相同,而电解质溶液不同,则电极反应式也不同,为易错点.

| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | NH3通入A1C13溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | B. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | C. | c(H+)•c(OH-) | D. | OH-的物质的量 |
| A. | 常温常压下,48 g O3中的氧原子数为3NA | |
| B. | 24 g金属镁变为镁离子时失去的电子数为NA | |
| C. | 4℃时9 mL水和标准状况下11.2 L氮气中的原子数均为NA | |
| D. | 2 mol•L-l的CuCl2溶液中含有的氯离子数为4NA |
| A. | 火炬燃料丙烷充分燃烧后只生成二氧化碳和水 | |
| B. | 撑杆跳高运动员使用的碳纤维撑杆属于有机高分子材料 | |
| C. | 泳池中加入的适量漂白粉可起到杀菌消毒作用 | |
| D. | 举重和体操运动员手上涂抹的碳酸镁白色粉末可吸水防滑 |
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |
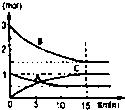 在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.
在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.