题目内容
7.室温下,向下列溶液中通入某气体至溶液呈中性(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )| A. | 向0.10mol/LNaHCO3溶液中通入CO2:c(Na+)=c(HCO3-)+c(CO32-) | |
| B. | 0.10mol/LNaF溶液中通入HCl:c(Na+)>c(HF)=c(Cl-) | |
| C. | 0.10mol/LNa2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/LNaHSO3溶液通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
分析 A.室温下,向下列溶液中通入某气体至溶液呈中性,pH=7,则c(H+)=c(OH-),结合电荷守恒分析;
B.0.10mol/LNaF溶液中通入HCl,结合溶液电荷守恒和物料守恒分析判断;
C.未反应前结合物料守恒可知c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],向0.10mol•L-1Na2SO3溶液通入SO2,至溶液pH=7,反应后溶液中溶质为NaHSO3、Na2SO3;
D.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立判断.
解答 解:A.室温下,向下列溶液中通入某气体至溶液呈中性,pH=7,则c(H+)=c(OH-),结合电荷守恒,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),c(Na+)=c(HCO3-)+2c(CO32-),故A错误;
B.0.10mol/LNaF溶液中通入HCl反应生成HF和NaCl,溶液呈中性,溶液中溶质为HF、NaCl和NaF,c(H+)=c(OH-),c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(F-),c(Na+)=c(Cl-)+c(F-),c(Na+)=c(F-)+c(HF),c(Na+)>c(Cl-)=c(HF),故B正确;
C.向0.10mol•L-1Na2SO3溶液通入SO2,发生Na2SO3+SO2+H2O=2NaHSO3,至溶液pH=7,反应后溶液中溶质为的NaHSO3、Na2SO3,则c(Na+)<2[c(SO32-)+c(HSO3-)+c(H2SO3)],故C错误;
D.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,故c(Na+)>c(NH4+),由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立可得:c(NH4+)+c(H2SO3)=c(SO32-),c(NH4+)<c(SO32-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,把握发生的反应、盐类水解及电离、溶液中电荷守恒和物料守恒为解答的关键,注意pH=7的信息及应用,题目难度中等.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A.烧碱溶液 B.浓硫酸 C.饱和食盐水 D.浓盐酸
请回答下列问题:
(l)乙醇的沸点比丙酮沸点高的主要原因是乙醇分子之间易形成氢键.
(2)加入甲溶液是A,(填A B C D序号),涉及到的反应方程式:CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH、CH3COOH+NaOH→CH3COONa+H2O.
(3)在70℃~85℃时馏出物的主要成分为乙醇.
(4)在步骤④中加入过量的乙溶液是B.(填A B C D序号),
(5)最后蒸馏的温度控制在117.9℃左右.
(6)在蒸馏操作中,仪器选择及安装都正确的是:(填标号)

如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理?b;移开热源,待温度降低,再投入沸石,重新加热.
| A. | 处理氯气实验中的尾气:OH-+Cl2═ClO-+Cl-+H2O | |
| B. | 硫酸铜与氢氧化钡溶液混合产生沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 用石灰石与稀盐酸制备二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 铜片放入浓硝酸中产生气体:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O |
| A. | 摩尔是国际单位制中的七个基本物理量之一 | |
| B. | 阿伏加德罗常数是0.012kg 12C中所含的原子数 | |
| C. | 摩尔质量与物质的量的多少有关,它等于物质的质量除以物质的量 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 |
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,所以用铝制容器存放盐酸 | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 铝既可以与强酸反应又可以与强碱反应 |
| A. | ①②④ | B. | ②③④ | C. | ①②③④ | D. | ②④ |
| A. | 硝酸银溶液中加入氯化钠:Ag++Cl-═AgCl↓ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
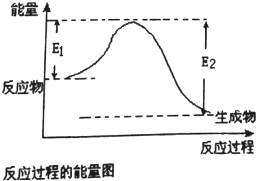 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: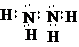 ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ. ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: