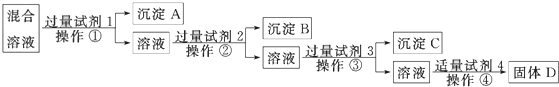
题目内容
2.下列叙述不正确的是( )| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,所以用铝制容器存放盐酸 | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 铝既可以与强酸反应又可以与强碱反应 |
分析 A、盐酸与氧化铝反应生成氯化铝和水;
B、氧化铝是两性氧化物既与酸反应又与碱反应;
C、利用胶体具有大的表面积,有吸附作用分析;
D、能和强酸、强碱反应的物质有铝、两性氧化物、两性氢氧化物、弱酸的铵盐、弱酸酸式盐等.
解答 解:A、盐酸与氧化铝反应生成氯化铝和水,所以不能用铝制容器存放盐酸,故A错误;
B、氧化铝是两性氧化物既与酸反应又与碱反应,铝与氢氧化钠反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故B正确;
C、明矾水解形成的Al(OH)3胶体具有较大的表面积能吸附水中悬浮物,可用于水的净化,故C正确;
D、能和强酸、强碱反应的物质有铝、两性氧化物、两性氢氧化物、弱酸的铵盐、弱酸酸式盐等,所以铝既可以与强酸反应又可以与强碱反应,故D正确;
故选A.
点评 本题考查了物质的性质,明确常见物质的性质是解本题关键,注意C中净水原理的不同点,注意基础知识的积累和运用,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
7.室温下,向下列溶液中通入某气体至溶液呈中性(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol/LNaHCO3溶液中通入CO2:c(Na+)=c(HCO3-)+c(CO32-) | |
| B. | 0.10mol/LNaF溶液中通入HCl:c(Na+)>c(HF)=c(Cl-) | |
| C. | 0.10mol/LNa2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/LNaHSO3溶液通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| B. | 室温下,31g白磷分子中含有共价键数目为4NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| D. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- |
12.下列离子方程式中正确的是( )
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:2OH-+CO2═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.