题目内容
4.有A、B、C、D四种金属,将A与B用导线连结起来,浸入电解质溶液中,A易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )| A. | D>A>B>C | B. | A>D>B>C | C. | D>A>C>B | D. | C>B>A>D |
分析 原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属,由此分析解答.
解答 解:两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将A与B用导线连接起来浸入电解质溶液中,A易腐蚀,所以A的活动性大于B.
金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜.如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C.
所以金属的活动性顺序为:D>A>B>C,故选A.
点评 本题考查了金属活动性强弱的判断,难度不大,能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列有关原电池的说法中正确的是( )
| A. | 在外电路中,电子由负极流向正极 | |
| B. | 在内电路中,电子由正极流向负极 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 原电池工作时,一定不会伴随着热能变化 |
15.下列物质的电子式书写正确的是( )
| A. | Na2O Na${\;}_{2}^{+}$[${\;}_{×}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{×}^{•}$]2- | |
| B. | H2S H+[${\;}_{×}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{×}^{•}$]2-H+ | |
| C. | H2O2 H${\;}_{×}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{×}^{•}$H | |
| D. | N2 N${\;}_{•}^{•}$${\;}_{•}^{•}$${\;}_{•}^{•}$N |
12.为鉴定卤代烃中所含卤素原子,现有下列实验操作步骤:①加入AgNO3溶液;②加入少许卤代烃试样;③加热;④加入5mL 4mol/L NaOH溶液;⑤加入5mL 4mol/L HNO3溶液.正确的顺序是( )
| A. | ②④③① | B. | ②③① | C. | ②④③⑤① | D. | ②⑤③① |
19.化学与STSE密切相关.下列有关说法中不正确的是( )
| A. | 合理利用太阳能、风能和氢能等能源有利于实现“低碳经济” | |
| B. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| C. | 利用可降解塑料可缓解白色污染 | |
| D. | 煤炭是清洁燃料,可直接燃烧,大量使用 |
9.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-═Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-═Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是阴极,氧化银是阳极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向Ag2O极移动,K+、H+向Zn极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH基本保持不变 |
13.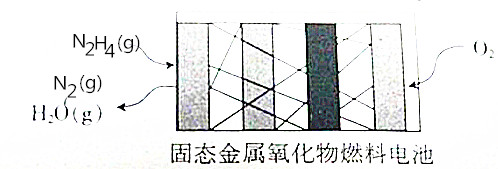 N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )
N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )
 N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )
N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )| A. | 通人N2H4的一极发生还原反应,该极为正极 | |
| B. | 正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 该电池将化学能全部转化为电能 | |
| D. | 电池反应式为N2H4+O2=N2+2H20 |