题目内容
13. N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )
N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )| A. | 通人N2H4的一极发生还原反应,该极为正极 | |
| B. | 正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 该电池将化学能全部转化为电能 | |
| D. | 电池反应式为N2H4+O2=N2+2H20 |
分析 肼、氧气和固态金属氧化物构成燃料电池,负极上肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极上氧气得电子生氧离子,正极反应为:O2+4e-=O2-,电池总反应为:N2H4+O2=N2+2H2O,据此回答.
解答 解:肼、氧气和固态金属氧化物构成燃料电池,负极上肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极上氧气得电子生氧离子,正极反应为:O2+4e-=2O2-,电池总反应为:N2H4+O2=N2+2H2O,
A、通人N2H4的一极发生氧化反应,该极为负极,故A错误;
B、正极的电极反应式为:O2+4e-=2O2-,故B错误;
C、该电池将化学能转化为电能和热能,不会完全转化为电能,故C错误;
D、电池总反应为:N2H4+O2=N2+2H2O,故D正确,
故选D.
点评 本题考查学生原电池的工作原理以及电极反应式的书写知识,注意知识的归纳和梳理是关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.如表陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选 项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可使纸张变黑 |
| D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
4.有A、B、C、D四种金属,将A与B用导线连结起来,浸入电解质溶液中,A易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | D>A>B>C | B. | A>D>B>C | C. | D>A>C>B | D. | C>B>A>D |
8.用惰性电极电解250mL NaCl和CuSO4的混合溶液,经过一段时间后,两电极分别得到11.2L气体(不考虑气体溶解),下列叙述中不正确的是( )
| A. | 阴极上有Cu析出 | |
| B. | 阴极上产生的气体是氢气 | |
| C. | 阳极上产生的气体是氯气和氧气混合气体 | |
| D. | 使溶液恢复到原来状态,需加人适量CuO并通适量HC1气体 |
6.下列各分子中所有原子都满足最外层为8电子稳定结构的是( )
| A. | H2O | B. | CH4 | C. | BF3 | D. | PCl3 |
7.相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)?3W(g)+2Z(g)△H=-Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出a kJ/mol | ||
| 乙 | 1mol | 1mol | 放出b kJ/mol | ||
| 丙 | 2mol | 2mol | 放出c kJ/mol | ||
| 丁 | 3mol | 2mol | 吸收d kJ/mol |
| A. | 平衡时丙容器中Z的物质的量浓度最大 | |
| B. | c+d<Q | |
| C. | 平衡时,甲容器中的反应速率比丁容器中的慢 | |
| D. | X的转化率为:甲<乙<丙 |

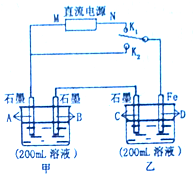 如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)
如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)