题目内容
16.把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生反应:3X(g)+Y(g)═nZ(g)+2W(g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为 0.03mol•L-1•min-1.计算:(1)n的值为3
(2)前5min内用X表示的反应速率0.03mol•(L•min)-1
(3)5min末Y的浓度0.15mol/L.
分析 (1)先计算出5min内Z的物质的量变化,根据物质的量与化学计量数成正比计算出n;
(2)根据化学反应速率与化学计量数成正比计算出前5min内用X表示的反应速率;
(3)根据Z的物质的量变化及Z与Y的计量数关系计算出5min内消耗Y的物质的量,然后计算出5min时Y的物质的量,最后根据c=$\frac{n}{V}$计算出5min末Y的浓度.
解答 解:(1)Z浓度变化来表示的平均速率为 0.03mol•L-1•min-1,则Z的物质的量变化为:0.03mol•L-1•min-1×2L×5min=0.3mol,根据物质的量之比等于计量数之比可知,n:2=0.3mol:0.2mol,解得;n=3,
故答案为:3;
(2)Z与X的化学计量数都是3,则前5min内用X表示的反应速率与Z表示的反应速率相等,都是0.03mol•(L•min)-1,
故答案为:0.03mol•(L•min)-1;
(3)5min内Z的物质的量变化为:0.03mol•L-1•min-1×2L×5min=0.3mol,根据反应3X(g)+Y(g)═3Z(g)+2W(g)可知5min末总共消耗Y的物质的量为:0.3mol×$\frac{1}{3}$=0.1mol,则5min末剩余Y的物质的量为:0.4mol-0.1mol=0.3mol,
所以5min末Y的物质的量浓度为:$\frac{0.3mol}{2L}$=0.15molL,
故答案为:0.15mol/L.
点评 本题考查了化学平衡、化学反应速率的计算,题目难度中等,明确化学反应速率的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
4.有A、B、C、D四种金属,将A与B用导线连结起来,浸入电解质溶液中,A易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | D>A>B>C | B. | A>D>B>C | C. | D>A>C>B | D. | C>B>A>D |
11.下列化学实验事实及解释或者结论都正确的是( )
| A. | 将某气体燃烧,在火焰的上方罩一个冷而干燥的烧杯,烧杯内壁有水珠生成,再将烧杯立即倒转并加入澄清石灰水溶液震荡,石灰水变浑浊,则该气体一定是烃 | |
| B. | 除去乙酸乙酯中少量的乙酸,用饱和的碳酸钠溶液洗涤,然后分液、干燥、蒸馏 | |
| C. | 1ml 1%的NaOH溶液中加入2ml 2%的CuSO4溶液,振荡后再加入0.5ml淀粉的水解液,加热后未出现砖红色沉淀,说明淀粉尚未水解 | |
| D. | 乙酸和乙醇的酯化反应实验中,向试管中加入试剂的顺序是:浓硫酸、乙醇、冰醋酸 |
8.用惰性电极电解250mL NaCl和CuSO4的混合溶液,经过一段时间后,两电极分别得到11.2L气体(不考虑气体溶解),下列叙述中不正确的是( )
| A. | 阴极上有Cu析出 | |
| B. | 阴极上产生的气体是氢气 | |
| C. | 阳极上产生的气体是氯气和氧气混合气体 | |
| D. | 使溶液恢复到原来状态,需加人适量CuO并通适量HC1气体 |
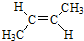 .
.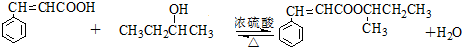 .
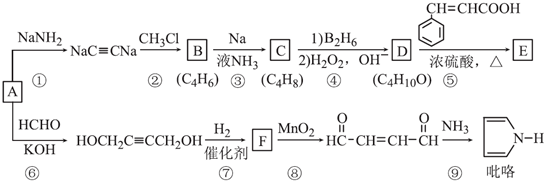
.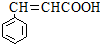 )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.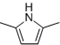 )的合成路线
)的合成路线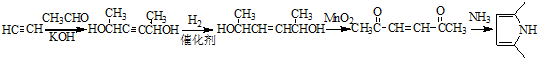 .
.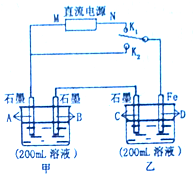 如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)
如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)