题目内容
14.下列有关原电池的说法中正确的是( )| A. | 在外电路中,电子由负极流向正极 | |
| B. | 在内电路中,电子由正极流向负极 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 原电池工作时,一定不会伴随着热能变化 |
分析 原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,即电子流出的是负极,正极上得电子发生还原反应,阳离子会移向正极.
解答 解:A、在内电路中是阴阳离子移动,外电路中电子由负极流向正极,故A正确;
B、在内电路中是阴阳离子移动,外电路中电子由负极流向正极,故B错误;
C、原电池工作时,正极上是溶液中的阳离子得电子,则正极表面可能有气泡产生,也可能生成金属单质,故C错误;
D、原电池工作时,化学能转变为电能,同时可能会伴随着热量变化,故D错误.
故选A.
点评 本题考查了原电池原理,难度不大,会判断电子在外电路的流向及溶液中阴阳离子的移动方向.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热一段时间后,溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | n(Na+):n(Cl-)可能为7:3 | |
| B. | 与NaOH反应的氯气一定为0.3mol | |
| C. | 当转移电子为n mol时,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为6:1:1 |
5.下列表示方法正确的是( )
| A. | HCl的电子式为 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: | D. | 用电子式表示MgCl2的形成: |
9.CH3-CH2-OH和CH3-O-CH3互为( )
| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
3.如表陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选 项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可使纸张变黑 |
| D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
4.有A、B、C、D四种金属,将A与B用导线连结起来,浸入电解质溶液中,A易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | D>A>B>C | B. | A>D>B>C | C. | D>A>C>B | D. | C>B>A>D |
 .
.
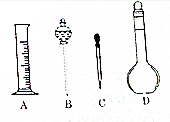 实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题
实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题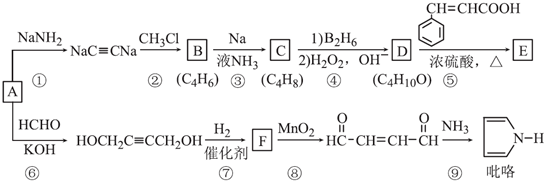
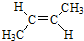 .
.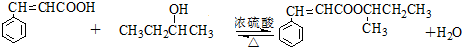 .
.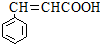 )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.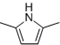 )的合成路线
)的合成路线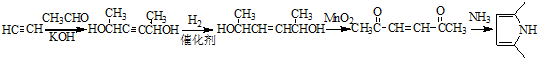 .
.