题目内容
2.25℃时,几种弱酸的电离常数如下:| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液PH关系为:PH(Na2S)>PH(NaCN)>PH(CH3COONa) | |
| B. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
分析 A.弱酸的电离常数越小,其酸性越弱,对应盐的水解能力越强,溶液的pH越大;
B.NaCN在溶液中发生水解,溶液显碱性;
C.根据溶液中的电荷守恒分析;
D.NaCN溶液中氢离子由水电离.
解答 解:A、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HS-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(CH3COONa),故A正确;
B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,若恰好反应生成NaCN,NaCN在溶液中发生水解,溶液显碱性,则c(Na+)>c(CN-),此时a=b,所以a不一定大于b,故B错误;
C、NaHS和Na2S的混合溶液中,存在的阳离子有Na+、H+,阴离子有OH-、HS-、S2-,根据溶液电中性,存在C(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故C错误;
D、某浓度的NaCN溶液的pH=d,该溶液中氢离子全部由水电离,则由水电离出的c(H+)=10-dmol/L,故D正确;
故选AD.
点评 本题考查弱电解质的电离平衡,涉及离子浓度大小比较,做题中注意外界条件对电离平衡的影响,利用电荷守恒、质量守恒解答此类题目,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
5.目前主要被用作肥料的无水氨如果稍加改进,就可以用在内燃机和氨燃料电池中,从而减轻对化石燃料的依赖.下列有关叙述中正确的是( )
| A. | 一旦将氨气用作燃料,将彻底解决能源危机 | |
| B. | 氨气燃烧的化学方程式可能为4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$4NO+6H2O | |
| C. | 比氢气更易储存,因为氨易液化 | |
| D. | 在氨燃料电池中,氨作正极 |
13.已知0.1mol•L-1的醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,要使溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ 值减小,可以采取的措施是( )
| A. | 加水 | B. | 加少量冰醋酸 | C. | 降低温度 | D. | 加少量烧碱溶液 |
17.用物质的量浓度相同的盐酸分别中和pH值相等、体积相同的氨水、氢氧化钠和氢氧化钡溶液,所消耗的盐酸体积依次用V1、V2、V3表示,它们之间的关系正确的是( )
| A. | V1>V2=V3 | B. | V1>V2>V3 | C. | V1=V2=V3 | D. | V1=V2<V3 |
7.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 16g由O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA | |
| C. | 100mL 12mol/L浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA | |
| D. | 0.3molAgNO3受热完全分解(2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ ),用排水收集到气体的分子数为0.25NA |
14.下列离子方程式书写正确的是( )
| A. | Na2SO3溶液中加入稀硝酸:SO32-+2H+═SO2↑+H2O | |
| B. | NH4HSO3溶液与少量的NaOH溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| C. | FeBr2溶液中通入足量的Cl2:4Fe2++4Br-+3Cl2═4Fe3++2Br2+6Cl- | |
| D. | 向碳酸氢钙溶液加入少量氢氧化钾溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
11.如图所示装置是“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中是否有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
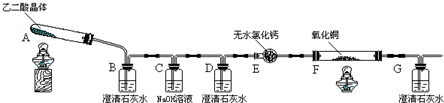
(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
12.如图,A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和锕系).下列说法不正确的是( )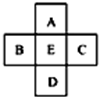

| A. | A、E原子序数之差可能为2 | B. | D、E原子序数之差可能是8、18或32 | ||
| C. | B、C原子序数之差一定是2 | D. | B、D原子序数之差不可能是7 |