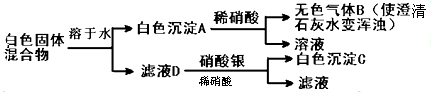
题目内容
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]又称摩尔盐.某兴趣小组为了制备硫酸亚铁铵,上网查阅到硫酸铵、硫酸亚铁、硫酸亚铁铵三种盐的溶解度(单位为g/100g水)如表:
1制备晶体.该兴趣小组设计了制取少量摩尔盐的流程如下:
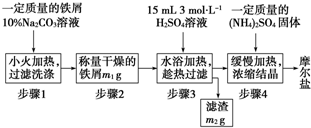
试回答下列问题:
①步骤3中进行“趁热快速过滤”,可采取的措施是 (写出1种),趁热过滤的目的是 ;
②步骤4中加热浓缩至 时为止;
③)步骤4中析出的晶体不含(NH4)2SO4、FeSO4的原因是 ,理论上制得的摩尔盐的质量为 .
(2)纯度分析.为了测定产品中Fe3+杂质含量,进行下列定量分析:
①配制Fe3+浓度为1.0mg/mL的标准溶液100mL.称取 mg高纯度的硫酸铁铵(NH4)Fe(SO4)2?12H2O,加2.00mL经处理的去离子水,振荡溶解后,加入2mol?L-1 HBr溶液1mL和1mol?L-1 KSCN溶液0.5mL,加水制成100mL溶液.配制过程中必须用到的定量仪器为 (选填编号).
a.精确度为0.001g的电子天平 b.精确度为0.1mg的电子天平
c.100mL容量瓶 d.酸式滴定管 e.10mL量筒
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液.分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如图.
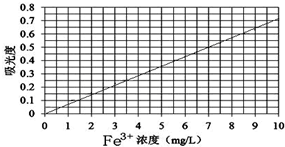
③取该兴趣小组所得的硫酸亚铁铵产品,按步骤①配得产品溶液10mL,稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.490、0.510,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为 mg/L.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4?FeSO4?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | - | - |

试回答下列问题:
①步骤3中进行“趁热快速过滤”,可采取的措施是
②步骤4中加热浓缩至
③)步骤4中析出的晶体不含(NH4)2SO4、FeSO4的原因是
(2)纯度分析.为了测定产品中Fe3+杂质含量,进行下列定量分析:
①配制Fe3+浓度为1.0mg/mL的标准溶液100mL.称取
a.精确度为0.001g的电子天平 b.精确度为0.1mg的电子天平
c.100mL容量瓶 d.酸式滴定管 e.10mL量筒
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液.分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如图.

③取该兴趣小组所得的硫酸亚铁铵产品,按步骤①配得产品溶液10mL,稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.490、0.510,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为
考点:制备实验方案的设计,探究物质的组成或测量物质的含量
专题:实验设计题
分析:(1)①FeSO4在低温时溶解度较小,如果不趁热过滤就会有FeSO4?7H2O晶体析出,过滤时会出现漏斗堵塞现象;
②加热浓缩至液体表面出现晶膜,即可停止加热;
③从题中溶解度表中可知:在相同温度下(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4都要小,摩尔盐先析出;
根据铁元素质量守恒可得关系式Fe~(NH4)2SO4?FeSO4?6H2O,然后根据铁的质量计算出生成高纯度的硫酸铁铵(NH4)Fe(SO4)2?12H2O的质量;
(2)①根据n=cV、m=nM计算出铁离子的质量,再依据关系式Fe3+~(NH4)Fe(SO4)2?12H2O得m[(NH4)Fe(SO4)2?12H2O];
根据配制一定物质的量浓度的溶液方法进行解答;
③两次测定所得的吸光度分别为0.490、0.510,计算出其取其平均值为0.500,然后结合图象中曲线数据计算出该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度.
②加热浓缩至液体表面出现晶膜,即可停止加热;
③从题中溶解度表中可知:在相同温度下(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4都要小,摩尔盐先析出;
根据铁元素质量守恒可得关系式Fe~(NH4)2SO4?FeSO4?6H2O,然后根据铁的质量计算出生成高纯度的硫酸铁铵(NH4)Fe(SO4)2?12H2O的质量;
(2)①根据n=cV、m=nM计算出铁离子的质量,再依据关系式Fe3+~(NH4)Fe(SO4)2?12H2O得m[(NH4)Fe(SO4)2?12H2O];
根据配制一定物质的量浓度的溶液方法进行解答;
③两次测定所得的吸光度分别为0.490、0.510,计算出其取其平均值为0.500,然后结合图象中曲线数据计算出该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度.
解答:
解:(1)①因为FeSO4在低温时溶解度较小,应采用趁热过滤,如果不趁热过滤就会有FeSO4?7H2O晶体析出,过滤时会出现漏斗堵塞现象,
故答案为:将漏斗置于沸水中预热后进行快速热过滤;防止FeSO4?7H2O晶体析出;
②加热浓缩至液体表面出现晶膜,停止加热,冷却使晶体析出,故答案为:液体表面出现晶膜;
③从题中溶解度表中得出在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4都要小,摩尔盐先析出;
根据铁元素质量守恒可得关系式Fe~(NH4)2SO4?FeSO4?6H2O,而M[(NH4)2SO4?FeSO4?6H2O]=392g?mol-1,
加入铁屑m1g,剩余的铁屑为m2,则溶解的铁粉的质量为:(m1-m2)g,
得出生成晶体的质量为:m[(NH4)2SO4?FeSO4?6H2O]=
×392g/mol=7(m1-m2)g,
故答案为:在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4都要小;7(m1-m2)g;
(2)①在Fe3+浓度为1.0mg/mL的标准溶液100mL中,m(Fe3+)=1.0mg/mL×100mL=100.0mg,
依据关系式Fe3+~(NH4)Fe(SO4)2?12H2O得:m[(NH4)Fe(SO4)2?12H2O]=100.0mg×
=860.7mg;
称取860.7mg晶体需精确度为0.1mg的电子天平,配制100 mL溶液,需100 mL容量瓶,即选bc,
故答案为:860.7; bc;
③两次测定所得的吸光度分别为0.490、0.510,取其平均值为0.500,从吸光度可以出浓度为7 mg/L,又因配得产品溶液10mL,稀释至100 mL,故原产品硫酸亚铁铵溶液中所含Fe3+浓度为:7mg/L×
=70mg/L,
故答案为:70.
故答案为:将漏斗置于沸水中预热后进行快速热过滤;防止FeSO4?7H2O晶体析出;
②加热浓缩至液体表面出现晶膜,停止加热,冷却使晶体析出,故答案为:液体表面出现晶膜;
③从题中溶解度表中得出在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4都要小,摩尔盐先析出;
根据铁元素质量守恒可得关系式Fe~(NH4)2SO4?FeSO4?6H2O,而M[(NH4)2SO4?FeSO4?6H2O]=392g?mol-1,
加入铁屑m1g,剩余的铁屑为m2,则溶解的铁粉的质量为:(m1-m2)g,
得出生成晶体的质量为:m[(NH4)2SO4?FeSO4?6H2O]=
| (m1-m2)g |
| 56g/mol |
故答案为:在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4都要小;7(m1-m2)g;
(2)①在Fe3+浓度为1.0mg/mL的标准溶液100mL中,m(Fe3+)=1.0mg/mL×100mL=100.0mg,
依据关系式Fe3+~(NH4)Fe(SO4)2?12H2O得:m[(NH4)Fe(SO4)2?12H2O]=100.0mg×
| 482 |
| 56 |
称取860.7mg晶体需精确度为0.1mg的电子天平,配制100 mL溶液,需100 mL容量瓶,即选bc,
故答案为:860.7; bc;
③两次测定所得的吸光度分别为0.490、0.510,取其平均值为0.500,从吸光度可以出浓度为7 mg/L,又因配得产品溶液10mL,稀释至100 mL,故原产品硫酸亚铁铵溶液中所含Fe3+浓度为:7mg/L×
| 100mL |
| 10mL |
故答案为:70.
点评:本题通过硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]的制备,考查了化学实验方案设计的方法,正确分析制备流程和反应原理为解答本题的关键,试题综合性较强、涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
在标准状况下,与12克氢气体积相等的氮气的( )
| A、质量为12克 |
| B、物质的量为6摩尔 |
| C、体积为22.4L/mol |
| D、物质的量为12mol |
用电石浆(主要成分是CaO、SiO2、Al2O3、Fe2O3、MgO、CaS 和其它不溶于酸的物质)生产无水CaCl2,工艺流程如下(已知氯化钙晶体的化学式是:CaCl2?6H2O),下列有关说法不正确的是( )
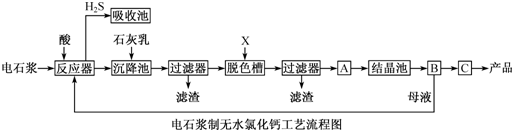

| A、反应器中加入的酸只能是盐酸 |
| B、脱色槽中应加入的X是为了脱色,所以可以选择活性炭或者过氧化钠 |
| C、氯化钙晶体CaCl2?6H2O可以直接脱水干燥得到无水CaCl2,无需在氯化氢的氛围下进行 |
| D、对设备B中产生的母液重新引入反应器,可以降低废弃物排放量,提高经济效益 |