题目内容
10.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CO3)=8.45×10-12,Ksp(AgBr)=7.7×10-13.某溶液中含有Cl-、CO32-和Br-浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )| A. | Cl-、Br-、CO32- | B. | Br-、CO32-、Cl- | C. | CO32-、Br-、Cl- | D. | Br-、Cl-、CO32- |
分析 析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L,AgBr溶液中c(Ag+)=$\frac{{K}_{sp}(AgBr)}{c({Br}^{-})}$=$\frac{7.7×1{0}^{-13}}{0.01}$mol/L,Ag2CO3溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}C{O}_{3})}{c(C{{O}_{3}}^{2-})}}$=$\sqrt{\frac{8.45×1{0}^{-12}}{0.01}}$mol/L,c(Ag+)越小,则越先生成沉淀,以此解答该题.
解答 解:析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L=1.56×10-8mol/L,
AgBr溶液中c(Ag+)=$\frac{{K}_{sp}(AgBr)}{c({Br}^{-})}$=$\frac{7.7×1{0}^{-13}}{0.01}$mol/L=7.7×10-11mol/L,
Ag2CO3溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}C{O}_{3})}{c(C{{O}_{3}}^{2-})}}$=$\sqrt{\frac{8.45×1{0}^{-12}}{0.01}}$mol/L=1.29×10-5,
c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CO32-,
故选D.
点评 本题考查难溶电解质的溶解平衡问题,为高频考点,侧重考查学生的分析能力和计算能力,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,易错点为B,组成不相似的物质,不能直接根据溶度积判断.

| A. | 反应①的平衡常数K1=$\frac{c(C{O}_{2})•c(Cu)}{c(CO)•c(CuO)}$ | |
| B. | 反应③的平衡常数K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 | |
| D. | 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小 |
| A. | 3molH2+1molN2 | B. | 2molNH3+1molN2 | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
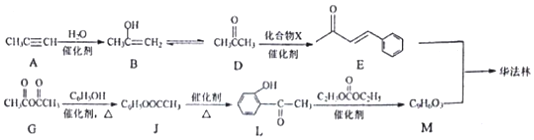
 .
.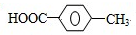 ,R→S的化学方程式为
,R→S的化学方程式为 .
.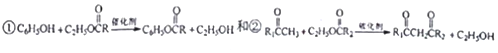
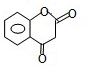 .
.
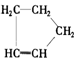 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 .环戊烯的化学性质跟烯烃相似.
.环戊烯的化学性质跟烯烃相似.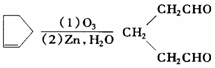
 )臭氧分解各种产物的结构简式及物质的量之比:HCHO、
)臭氧分解各种产物的结构简式及物质的量之比:HCHO、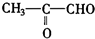 ;2:1.
;2:1.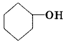 )合成乙二醛(
)合成乙二醛( 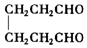 )的各步合成路线流程.
)的各步合成路线流程.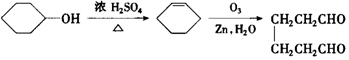 .
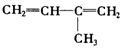
.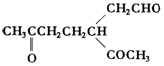 .A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).
.A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).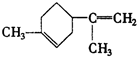 ,B是
,B是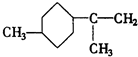 .
.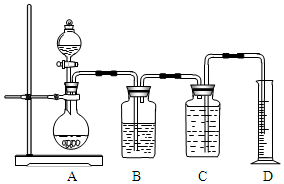 如图所示装置可用于多种实验.
如图所示装置可用于多种实验.