题目内容
下列表达方式正确的是( )
| A、乙烯的结构简式CH2CH2 |
B、基态氧原子L层电子排布图: |
C、甲基的电子式  |
| D、HClO的结构式:H-Cl-O |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.乙烯的结构简式必须表示出碳碳双键;
B.2p电子的自旋方向相同时具有最低能量;
C.甲基中含有3个碳氢键,碳原子最外层含有7个电子;
D.次氯酸的中心原子是氧原子,分子中不存在氢氯键.
B.2p电子的自旋方向相同时具有最低能量;
C.甲基中含有3个碳氢键,碳原子最外层含有7个电子;
D.次氯酸的中心原子是氧原子,分子中不存在氢氯键.
解答:
解:A.乙烯分子中含有碳碳双键,乙烯的结构简式应该为:CH2=CH2,故A错误;
B.氧原子的L层电子的2p轨道电子的自旋方向应该相同,基态氧原子L层电子排布图为: 故B错误;
故B错误;
C.甲基为甲烷失去1个H原子形成的,碳原子最外层为7个电子,甲基的电子式为: ,故C正确;
,故C正确;
D.次氯酸的中心原子是氧原子,正确的结构式为:H-O-Cl,故D错误;
故选C.
B.氧原子的L层电子的2p轨道电子的自旋方向应该相同,基态氧原子L层电子排布图为:
 故B错误;
故B错误;C.甲基为甲烷失去1个H原子形成的,碳原子最外层为7个电子,甲基的电子式为:
 ,故C正确;
,故C正确;D.次氯酸的中心原子是氧原子,正确的结构式为:H-O-Cl,故D错误;
故选C.
点评:本题考查了常见化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,选项D中需要明确次氯酸的中心原子是O元素,为易错点.

练习册系列答案
相关题目
下列实验方法能达到目的是( )
| A、用氨水清洗试管内壁附着的银镜 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+ |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②少许H2O ③升温 ④CH3COONa固体 ⑤降温 ⑥KCl溶液.
①NaOH固体 ②少许H2O ③升温 ④CH3COONa固体 ⑤降温 ⑥KCl溶液.
| A、②④⑤⑥ | B、①② |
| C、②③⑤ | D、②⑤⑥ |
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列途径制取:

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )
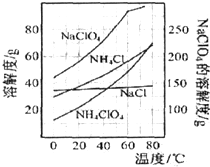

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )

| A、制得粗产品的反应原理为:NH4Cl+NaClO4=NaCl+NH4ClO4↓ |
| B、上述流程中操作Ⅰ为冷却结晶,操作Ⅱ为重结晶 |
| C、洗涤粗产品时,宜用冷水洗涤 |
| D、上述流程中蒸发浓缩时,蒸发至剩余少量溶液时,应停止加热,利用余热将其蒸干,防止晶体飞溅 |
铁及其合金在生产、生活中应用广泛,下列说法中正确的是( )
| A、生铁中含有碳,抗腐蚀能力比纯铁强 |
| B、铁与盐溶液所发生的反应都是置换反应 |
| C、铁与稀硫酸反应,铁与浓硫酸不能反应 |
| D、工业上可以用铝热反应的方法制取少量的铁 |

 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题: (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.