题目内容
 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
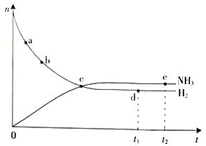
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如右下图所示.
下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2 (g)═2NH3(g)△H=-92.4kJ?mol-1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②合成氨工业中采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由
③在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为
考点:物质的量或浓度随时间的变化曲线,化学平衡移动原理,化学平衡的计算
专题:化学平衡专题
分析:(1)在N2(g)+3H2(g)?2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项;
(2)①勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,与平衡移动无关,则不能用勒沙特列原理解释;
②考虑工业生产成本和技术问题;
③根据三段式计算各组分的浓度,再根据平衡常数计算公式计算.
(2)①勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,与平衡移动无关,则不能用勒沙特列原理解释;
②考虑工业生产成本和技术问题;
③根据三段式计算各组分的浓度,再根据平衡常数计算公式计算.
解答:
解:(1)A.随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A正确;
B.c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;
C.d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氢气的物质的量增大,故D正确;
故答案为:A、D;
(2)①A、高于常压,增大压强,化学平衡会正向移动,有利于氨气的合成,能用勒沙特列原理解释,故错误;
B、500℃的高温,不有利于氨气的合成,但是可以提高催化剂的催化活性,不能用勒沙特列原理解释,故正确;
C、铁触媒作催化剂,不会引起化学平衡的移动,不能用勒沙特列原理解释,故正确;
D、将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中,都会使得化学平衡正向移动,有利于氨的合成,能用勒沙特列原理解释,故错误;
故选B、C;
②虽然增大压强,化学平衡会正向移动,有利于氨气的合成,但是压强越大,消耗的动力越大,对设备的要求越高,而总体经济效益提高不大,
故答案为:压强越大,消耗的动力越大,对设备的要求越高,而总体经济效益提高不大;
③N2(g)+3H2(g)═2NH3(g)
起始(mol/L) 1 3 0
变化(mol/L) x 3x 2x
平衡(mol/L) 1-x 3-3x 2x
N2转化率分别为α甲=
,x=α甲,
平衡常数K=
=
=
,
甲的压强大于乙的压强,平衡右移,N2转化率增大,故α甲>α乙,
故答案为:
;>.
B.c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;
C.d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氢气的物质的量增大,故D正确;
故答案为:A、D;
(2)①A、高于常压,增大压强,化学平衡会正向移动,有利于氨气的合成,能用勒沙特列原理解释,故错误;
B、500℃的高温,不有利于氨气的合成,但是可以提高催化剂的催化活性,不能用勒沙特列原理解释,故正确;
C、铁触媒作催化剂,不会引起化学平衡的移动,不能用勒沙特列原理解释,故正确;
D、将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中,都会使得化学平衡正向移动,有利于氨的合成,能用勒沙特列原理解释,故错误;
故选B、C;
②虽然增大压强,化学平衡会正向移动,有利于氨气的合成,但是压强越大,消耗的动力越大,对设备的要求越高,而总体经济效益提高不大,
故答案为:压强越大,消耗的动力越大,对设备的要求越高,而总体经济效益提高不大;
③N2(g)+3H2(g)═2NH3(g)
起始(mol/L) 1 3 0
变化(mol/L) x 3x 2x
平衡(mol/L) 1-x 3-3x 2x
N2转化率分别为α甲=
| x |
| 1 |
平衡常数K=
| c2(NH3) |
| c(N2)?c3(H2) |
| (2x)2 |
| (1-x)×(3-3x)3 |
| 4α甲2 |
| 27(1-α甲)4 |
甲的压强大于乙的压强,平衡右移,N2转化率增大,故α甲>α乙,
故答案为:
| 4α甲2 |
| 27(1-α甲)4 |
点评:本题考查较综合,涉及化学平衡的计算、影响平衡的因素等,注重高考常考查点的考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列表达方式正确的是( )
| A、乙烯的结构简式CH2CH2 |
B、基态氧原子L层电子排布图: |
C、甲基的电子式  |
| D、HClO的结构式:H-Cl-O |
在一定密闭容器中,反应aA(g)═bB(g)达平衡后,保持温度及各物质的量不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、容器体积增加可以是向其中充入了惰性气体 |
| D、a<b |
在0.1mol?L-1的醋酸溶液中,存在电离平衡CH3COOH?CH3COO-+H+,如果要使平衡向逆反应方向移动,同时增大c(H+),应采用的方法是( )
| A、加入0.01 mol?L-1的CH3COOH溶液 |
| B、加入CH3COONa固体 |
| C、稀释 |
| D、加入浓盐酸 |
下列关于“纯碱”的分类正确的是( )
| A、酸 | B、碱 | C、盐 | D、电解质 |
 烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:
烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务: