题目内容
15. Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①
Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①II.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.
该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4.
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL.
(1)滴定时,将酸性KMnO4标准液装在如图中的甲(填“甲”或“乙”)滴定管中.
(2)本实验滴定达到终点的标志可以是当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点.
(3)通过上述数据,求得x=2.
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会偏大(填“偏大”、“偏小”或“不变”,下同).
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会偏小.
分析 Ⅰ.一水合氨是弱电解质,相同浓度的这几种溶液中铵根离子浓度最小,碳酸氢根离子促进铵根离子水解、氢离子抑制铵根离子水解,根据离子水解程度结合化学式确定铵根离子浓度大小;
Ⅱ.(1)KMnO4具有强氧化性,会腐蚀橡胶管;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点;
(3)由题给化学方程式及数据计算出1.260g纯草酸晶体中含H2C2O4的物质的量,然后求出1.260g 纯草酸晶体中含H2O的物质的量,根据H2O的物质的量和纯草酸晶体的物质的量的关系求出x;若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,会导致浓度变小.
解答 解:I.一水合氨是弱电解质,在水溶液里部分电离,所以相同浓度的这几种溶液中铵根离子浓度最小,硫酸铵中铵根离子个数是2,所以硫酸铵中铵根离子浓度最大,碳酸氢根离子促进铵根离子水解、氢离子抑制铵根离子水解,所以氯化铵、碳酸氢铵、硫酸氢铵中铵根离子浓度大小顺序是④>②>③,则相同浓度的这几种溶液中c(NH4+)的由大到小顺序是⑤>④>②>③>①,
故答案为:⑤>④>②>③>①;
II. (1)因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装,故答案为:甲;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色,
故答案为:当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(3)2MnO4-+5H2C2O4 +6H+═2Mn2++10CO2↑+8H2O
2 5
0.1000mol/L×0.01L 0.0025mol
25.00mL待测液中含有0.0025molH2C2O4,100.00mL待测液中含有0.01molH2C2O4,0.01molH2C2O4的质量为0.01mol
×90g/mol=0.9g,所以1.260g纯草酸晶体中水的物质的量为1.260g-0.9g=0.36g,其物质的量为0.02mol,则x=2,
故答案为:2;
①若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大,
故答案为:偏大;
②若酸性KMnO4溶液因久置而导致浓度变小,则消耗其体积偏大,所得x值偏小,
故答案为:偏小.
点评 本题考查中物质的含量的测定、盐类水解,为高考常见题型,题目难度中等,明确弱电解质的电离及盐类水解特点、中和滴定的操作方法为解答关键,注意掌中和滴定的误差分析方法与技巧,试题培养了学生的分析能力及化学计算能力.

①C(s)+2H2(g)→CH4(g)△H1
②2C(s)+H2(g)→C2H2(g)△H2
③2C(s)+2H2(g)→C2H4 (g)△H3.
| A. | △H2>△H3>2△H1 | B. | △H1>△H2>△H3 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△Hl |
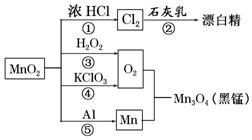
| A. | 只有反应①②④属于氧化还原反应 | |
| B. | 反应⑤说明该条件下铝可用于制熔点较高的金属 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:4 |
 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
(1)某温度下,2SO2(g)+O 2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度450℃;压强1×105Pa.
| 压强 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO 3的浓度不变 D.c(SO 2)=c(SO 3)
E.v 正(SO 2)=v 正(SO 3) F.v 正(SO 3)=2v 逆(O 2)
Ⅱ研究化学反应原理对于生产生活是很有意义的.
(1)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).
(2)若在0.1mol•L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2mol•L-1.
 ,其中-R为烃基.
,其中-R为烃基.
 ;C的结构简式
;C的结构简式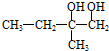 .
. .
.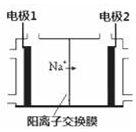 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.