题目内容
1.Ⅰ工业制硫酸时,利用接触氧化反应将SO 2转化为SO3是一个关键步骤.(1)某温度下,2SO2(g)+O 2(g)═2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(mol/L)-1(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度450℃;压强1×105Pa.
| 压强 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO 3的浓度不变 D.c(SO 2)=c(SO 3)
E.v 正(SO 2)=v 正(SO 3) F.v 正(SO 3)=2v 逆(O 2)
Ⅱ研究化学反应原理对于生产生活是很有意义的.
(1)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).
(2)若在0.1mol•L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2mol•L-1.
分析 Ⅰ(1)根据热化学方程式及放出的热量可计算出平衡时各物质的物质的量,进而求得平衡浓度,根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数,根据温度对平衡的影响判断K的变化;
(2)A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率;
B.减小一种反应物的浓度可以降低另一种反应物的转化率;
C.增大压强,平衡向体积减小的方向移动;
D.减小压强,平衡向体积增大的方向移动;
E.加入催化剂,对平衡没有影响;
(3)根据表中数据,在温度一定时,压强对转化率的影响,在压强一定时,温度对转化率的影响,据此选择合适的条件;
(4)根据正逆反应速率相等、各组份的组成不变以及某些外部特征可判断反应是否处于平衡状态;
Ⅱ(1)根据溶度积常数及溶液中氢氧根离子浓度计算出c(Cu2+);
(2)在0.1mol/L硫酸铜溶液中通入过量H2S气体,硫酸根离子浓度为0.1mol/L,根据溶液的电中性计算H+浓度.
解答 解:Ⅰ(1)根据反应2SO2(g)+O 2(g)?2SO3(g)△H=-197kJ/mol,当放出394kJ的热量时,生成SO3的物质的量为394/197×2mol=4mol,所以平衡时SO2的浓度为 $\frac{8.0mol-4mol}{10L}$=0.4mol/L,SO3的浓度为0.4mol/L,O2的浓度为 $\frac{20mol-2mol}{10L}$=1.8mol/L,所以K=$\frac{0.42}{0.42×1.8}$=0.56,该反应为放热反应,所以升高温度平衡向逆反应方程移动,平衡常数减小,
故答为:0.56;减小;
(2)A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率,所以通入氧气,二氧化硫的转化率提高,故A正确;
B.减小一种反应物的浓度可以降低另一种反应物的转化率,所以移出氧气,二氧化硫的转化下降高,故B错误;
C.该反应为体积减小的反应,增大压强,平衡向体积减小的方向移动,二氧化硫的转化率提高,故C正确;
D.减小压强,平衡向体积增大的方向移动,二氧化硫的转化率减小,故D错误;
E.加入催化剂,对平衡没有影响;
故选AC;
(3)根据表中数据,在温度一定时,压强越大,二氧化硫的转化率越高,但增加的幅度不大,在压强一定时,温度越高转化率越小,考滤生成成本等因素,所以选择的条件是450℃,1×105Pa,
故答案为:450℃;1×105Pa;
(4)A.该反应为体积减小的反应,所以容器的压强不变,反应达到平衡状态,故A正确;
B.该反应前后气体质量守恒,体积不变,所以混合气体的密度不变,不能判断反应是否处于平衡状态,故B错误;
C.混合气体中SO3的浓度不变,则反应处于平衡状态,故C正确;
D.C(SO2)=C(SO3),不能说明正逆反应速率是否相等,故D错误;
E.v 正(SO2)=v 正(SO3),都是指正反应速率,不能确定与逆反应的关系,故E错误;
F.v 正(SO3)=2v 逆(O2),说明正逆反应速率相等,所以反应处于平衡状态,故F正确,
故选:ACF;
Ⅱ(1)根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=2.2×10-20,则:c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-6})^{2}}$=2.2×10-8mol•L-1;
故答案为:2.2×10-8;
(2)在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1mol•L-1,由电荷守恒可知c(H+)为0.2mol•L-1,
故答案为:0.2.
点评 本题考查了平衡状态的判断、化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.

 阅读快车系列答案
阅读快车系列答案| A. | 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 | |
| B. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| C. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| D. | 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子 |
 CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.
CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分的体积分数如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3kJ•mol-1.
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸.
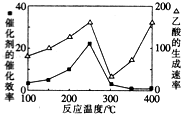
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)以CO2为原料可以合成多种物质.
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的.写出聚碳酸酯的结构简式:
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为CO2+8e-+6H2O=CH4+8OH-.
(1)按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
(3)区别⑦和⑨的方法是丁达尔效应,将⑨滴加到⑦中至过量的实验现象是先产生红褐色沉淀,后沉淀溶解
(4)向⑧中通入③至恰好完全反应,则⑧的导电能力的变化为由弱变强
(5)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时的离子方程式为Ba2++OH-+H++SO42-═BaSO4↓+H2O.
 Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①
Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①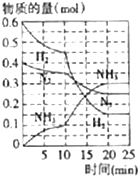 氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:
氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)