题目内容
7.根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )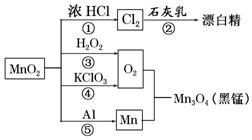
| A. | 只有反应①②④属于氧化还原反应 | |
| B. | 反应⑤说明该条件下铝可用于制熔点较高的金属 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:4 |
分析 A.①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰反应铝热反应生成Mn和氧化铝;
B.⑤为铝热反应,放出大量的热;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0;
D.①中Mn元素的化合价有+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0.
解答 解:A.①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水合氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰反应铝热反应生成Mn和氧化铝,均存在元素的化合价变化,均属于氧化还原反应,故A错误;
B.⑤为铝热反应,放出大量的热,可用于制熔点较高的金属,故B正确;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0,则相同条件下生成等量的O2,反应③和④转移的电子数之比为1:2,故C错误;
D.反应①4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素的化合价判断及电子守恒应用,题目难度不大.

练习册系列答案
相关题目
17.下列每组各有两对物质,它们都能用分液漏斗分离的是( )
| A. | 四氯化碳和水,苯和水 | B. | 汽油和水,乙醇和水 | ||
| C. | 乙醇和水,植物油和水 | D. | 醋酸和水,酒精和水 |
2.下列物质不属于“城市空气质量日报”报道内容的是( )
| A. | 二氧化碳 | B. | 悬浮颗粒 | C. | 二氧化硫 | D. | 二氧化氮 |
12. 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 增大C的浓度 | C. | 加入催化剂 | D. | 升高温度 |
19.某化学反应进行到一定程度时,达到化学平衡状态,则该反应一定是( )
| A. | 所有的化学反应 | B. | 可逆反应 | ||
| C. | 氧化还原反应 | D. | 气体物质之间的反应 |
16.具有如下电子层结构的原子,其相应元素一定属于同一主族的是( )
| A. | 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 | |
| B. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| C. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| D. | 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子 |
 Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①
Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>① 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)