题目内容
5.现有下列10种物质:①稀硝酸 ②空气 ③铝 ④CaO ⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4•5H2O ⑧碘酒 ⑨C2H5OH ⑩NaHCO3 用序号填空:属于混合物的是①②⑧;属于酸的是⑤;可以导电的有①③.分析 根据混合物由两种或两种以上不同物质组成的物质;
酸是指在电离时产生的阳离子全部是氢离子的化合物;
可以导电的物质有自由电子,或能电离出自由移动的离子,以此解答该题.
解答 解:①稀硝酸、②空气,⑧碘酒由两种或两种以上不同物质组成的物质组成,为混合物;
⑤H2SO4电离出的阳离子全部是氢离子,属于酸;
①稀硝酸能电离出自由移动的阴阳离子,③铝中有自由电子,可以导电,
故答案为:①②⑧;⑤;①③.
点评 本题考查物质的分类,题目难度不大,注意把握物质的组成和分类依据.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
15.CH4是一种重要的化石燃料,在工农业生产中有着极其重要的应用.用甲烷可以消除氮氧化物的污染,其反应如下:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g).
在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如表:
(1)130℃时,达到平衡状态时CH4的转化率为80%.当温度为180℃、反应到40min时,该反应是(填“是”或“否”)达到平衡,推断的依据是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.
(2)由表中数据分析可知,该反应的△H<0(填“=”、“>”或“<”),130℃和180℃平衡常数的关系:K(130℃)>K(180℃)(填“=”、“>”或“<”).
(3)如图1所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
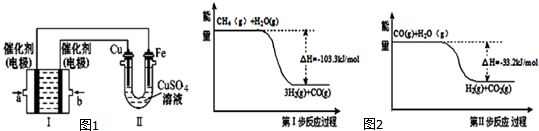
①a电极上发生反应的电极反应式是CH4+10OH--8e-=CO32-+7H2O.
②电镀结束后,装置Ⅰ中溶液的pH减小(填“增大”、“减小”或“不变”).
③若完全反应后,装置Ⅱ中Cu极质量减少12.8g,则装置Ⅰ中理论上消耗甲烷1.12L(标准状况下).
(4)用甲烷制取氢气的反应分为两步,其能量变化如图2所示:
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol.
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g).
在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如表:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(2)由表中数据分析可知,该反应的△H<0(填“=”、“>”或“<”),130℃和180℃平衡常数的关系:K(130℃)>K(180℃)(填“=”、“>”或“<”).
(3)如图1所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.

①a电极上发生反应的电极反应式是CH4+10OH--8e-=CO32-+7H2O.
②电镀结束后,装置Ⅰ中溶液的pH减小(填“增大”、“减小”或“不变”).
③若完全反应后,装置Ⅱ中Cu极质量减少12.8g,则装置Ⅰ中理论上消耗甲烷1.12L(标准状况下).
(4)用甲烷制取氢气的反应分为两步,其能量变化如图2所示:
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol.
13.由于易被氧化而不能长期存放在敞口容器中的是( )
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 绿矾 | D. | 氢氧化钠固体 |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下含有NA个氦原子的氦气的体积约为11.2L | |
| B. | 1 L 0.1 mol/LNaHSO4溶液中含有0.1NA个HSO4- | |
| C. | 标准状况下,22.4 L CCl4所含的分子数约为NA | |
| D. | CO和N2组成的42g混合气体中原子的个数为3NA |
10.把石灰石浸入盐酸中,下列措施能使反应速率增大的是( )
| A. | 加大盐酸用量 | B. | 减小盐酸浓度 | C. | 粉碎石灰石 | D. | 增大体系压强 |
17.下列每组各有两对物质,它们都能用分液漏斗分离的是( )
| A. | 四氯化碳和水,苯和水 | B. | 汽油和水,乙醇和水 | ||
| C. | 乙醇和水,植物油和水 | D. | 醋酸和水,酒精和水 |
 Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①
Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①