题目内容
N和S是中学化学中重要的非金属元素,回答下列问题:
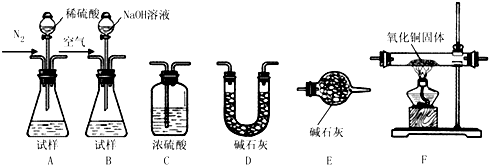
(1)实验室中用Cu分别和浓硫酸、浓硝酸反应制取并收集SO2、NO2,两者都需要下列仪器中的 (填编号)
(2)向含1molNaOH的溶液中通入1molSO2恰好完全反应,生成的盐为 ,此时的溶液呈酸性,其原因是 .
(3)液氨的某些性质与水相似.已知水分子自身能发生自偶电离,生成的阴、阳离子均含有10个电子.写出液氨分子发生自偶电离的方程式 ;
液氨与Na反应的化学方程式为 .
(4)用水稀释0.1mol?L-1氨水时,随着水量的增加而不变的是 (填序号)
a.
b.
c.c(OH-)?c(H+) d.
(5)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则每生成1mol N2的同时,生成 mol SO2.
(1)实验室中用Cu分别和浓硫酸、浓硝酸反应制取并收集SO2、NO2,两者都需要下列仪器中的

(2)向含1molNaOH的溶液中通入1molSO2恰好完全反应,生成的盐为
(3)液氨的某些性质与水相似.已知水分子自身能发生自偶电离,生成的阴、阳离子均含有10个电子.写出液氨分子发生自偶电离的方程式
液氨与Na反应的化学方程式为
(4)用水稀释0.1mol?L-1氨水时,随着水量的增加而不变的是
a.
c(OH-)?c(N
| ||
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) |
| c(OH-) |
(5)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则每生成1mol N2的同时,生成
考点:性质实验方案的设计
专题:实验设计题
分析:(1)无论便于控制反应,需要选用分液漏斗盛放浓硫酸或浓硝酸,然后根据二氧化硫、二氧化氮的性质判断收集方法及尾气处理方法;
(2)氢氧化钠与二氧化硫的物质的量相等,二者恰好反应生成亚硫酸氢钠;亚硫酸氢根离子的电离程度大于其水解程度,溶液显示酸性;
(3)生成的阴、阳离子均含有10个电子,此两种离子为:NH4+、NH2-,据此写出液氨分子发生自偶电离的方程式;液氨与Na反应生成NaNH2和氢气,据此写出反应的化学方程式;
(4)用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3?H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3?H2O)减少;
(5)(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,反应中氮气为氧化产物、二氧化硫为还原产物,根据电子守恒计算出生成二氧化硫的物质的量.
(2)氢氧化钠与二氧化硫的物质的量相等,二者恰好反应生成亚硫酸氢钠;亚硫酸氢根离子的电离程度大于其水解程度,溶液显示酸性;
(3)生成的阴、阳离子均含有10个电子,此两种离子为:NH4+、NH2-,据此写出液氨分子发生自偶电离的方程式;液氨与Na反应生成NaNH2和氢气,据此写出反应的化学方程式;
(4)用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3?H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3?H2O)减少;
(5)(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,反应中氮气为氧化产物、二氧化硫为还原产物,根据电子守恒计算出生成二氧化硫的物质的量.
解答:
解:(1)实验室中用Cu分别和浓硫酸、浓硝酸反应制取并收集SO2、NO2,无论方便控制反应,盛放浓硫酸、浓硝酸的仪器应该使用分液漏斗,所以气体发生装置应该选用B;SO2、NO2的密度大于空气,需要使用向下排空气法收集,收集装置需要选用C;无论防止倒吸,完全吸收装置应该选用F,
故答案为:BCF;
(2)向含1molNaOH的溶液中通入1molSO2恰好完全反应,二者恰好反应生成NaHSO3;
由于HSO3-的电离程度大于水解程度,则溶液显示酸性,
故答案为:NaHSO3 ;HSO3-的电离程度大于水解程度;
(3)液氨的某些性质与水相似.已知水分子自身能发生自偶电离,生成的阴、阳离子均含有10个电子,两种离子为:NH4+、NH2-,则液氨分子发生自偶电离的方程式:2NH3?NH4++NH2-;
液氨与Na反应生成NaNH2和氢气,反应的化学方程式为:2Na+2NH3═2NaNH2+H2↑,
故答案为:2NH3?NH4++NH2-;2Na+2NH3═2NaNH2+H2↑;
(4)a.由NH3?H2O?OH-+NH4+可知,
为平衡常数,随温度变化,用水稀释后其数值不变,故a正确;
b.由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,
减小,故b错误;
c.c(OH-)?c(H+)的乘积为水的离子积,加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故c正确;
d.氨水稀释后,溶液中氢氧根离子浓度减小,则氢离子浓度增大,
的值增大,故d错误;
故答案为:a c;
(5)(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,铵根离子生成N2,生成1molN2失去6mol电子,硫酸根离子生成SO2,化合价降低2价,根据电子守恒,则生成1mo氮气时同时生成二氧化碳的物质的量为:
=3mol,
故答案为:3.
故答案为:BCF;
(2)向含1molNaOH的溶液中通入1molSO2恰好完全反应,二者恰好反应生成NaHSO3;
由于HSO3-的电离程度大于水解程度,则溶液显示酸性,
故答案为:NaHSO3 ;HSO3-的电离程度大于水解程度;
(3)液氨的某些性质与水相似.已知水分子自身能发生自偶电离,生成的阴、阳离子均含有10个电子,两种离子为:NH4+、NH2-,则液氨分子发生自偶电离的方程式:2NH3?NH4++NH2-;
液氨与Na反应生成NaNH2和氢气,反应的化学方程式为:2Na+2NH3═2NaNH2+H2↑,
故答案为:2NH3?NH4++NH2-;2Na+2NH3═2NaNH2+H2↑;
(4)a.由NH3?H2O?OH-+NH4+可知,
c(OH-)?c(N
| ||
| c(NH3?H2O) |
b.由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,
| c(NH3?H2O) |
| c(OH-) |
c.c(OH-)?c(H+)的乘积为水的离子积,加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故c正确;
d.氨水稀释后,溶液中氢氧根离子浓度减小,则氢离子浓度增大,
| c(H+) |
| c(OH-) |
故答案为:a c;
(5)(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,铵根离子生成N2,生成1molN2失去6mol电子,硫酸根离子生成SO2,化合价降低2价,根据电子守恒,则生成1mo氮气时同时生成二氧化碳的物质的量为:
| 6mol |
| 2 |
故答案为:3.
点评:本题考查了物质制备及装置选用、盐的水解、氧化还原反应的计算等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.

练习册系列答案
相关题目
下列关于工业生产说法正确的是 ( )
| A、在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B、在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D、工业上采用电解熔融氯化铝的方法制取金属铝 |
| E、石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃 |
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
| A、容量瓶事先未烘干 |
| B、称量KOH时天平砝码已生锈 |
| C、定容时观察液面仰视 |
| D、未冷却至室温就移液定容 |
下列各溶液不能与铜发生反应的是( )
| A、浓盐酸 |
| B、浓H2SO4 |
| C、浓硝酸 |
| D、稀硝酸 |
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.