题目内容
元素X、Y、Z、W均为短周期元素,且原子序数依次增大.已知Y原子最外层电子数占核外电子总数的
,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素.据此回答下列问题:
(1)W在元素周期表中的位置 ,实验室制取W单质的离子方程式是 ;
(2)A、B均由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1.其中B是某种家用消毒液的有效成分,则A、B的化学式分别为 、 ;
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1:1,则C中含有的化学键类型是 ;
(4)用B在碱性条件下处理含CN-的工业废水,将得到一种能够参与大气生态环境循环的气体以及CO32-、W-等,请写出该反应的离子方程式 (不必配平).
| 3 |
| 4 |
(1)W在元素周期表中的位置
(2)A、B均由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1.其中B是某种家用消毒液的有效成分,则A、B的化学式分别为
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1:1,则C中含有的化学键类型是
(4)用B在碱性条件下处理含CN-的工业废水,将得到一种能够参与大气生态环境循环的气体以及CO32-、W-等,请写出该反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Y原子最外层电子数占核外电子总数的
,则最外层电子数应为6,原子的核外电子总数为8,应为O元素,Z是本周期中除稀有气体元素外,原子半径最大的元素,且原子序数大于O,应为第三周期Na元素,W带1个负电荷,应为第ⅦA族元素,且原子序数大于Na的,应为Cl元素,X带1个正电荷,应为第ⅠA族元素,且化合物XW常温下为气体,说明X为H元素,结合元素对应的单质、化合物的性质解答该题.
| 3 |
| 4 |
解答:
解:Y原子最外层电子数占核外电子总数的
,则最外层电子数应为6,原子的核外电子总数为8,应为O元素,Z是本周期中除稀有气体元素外,原子半径最大的元素,且原子序数大于O,应为第三周期Na元素,W带1个负电荷,应为第ⅦA族元素,且原子序数大于Na的,应为Cl元素,X带1个正电荷,应为第ⅠA族元素,且化合物XW常温下为气体,说明X为H元素素,则:
(1)W为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子为7,应位于周期表第三周期ⅦA族;实验室用MnO2和浓盐酸在加热条件下制备Cl2,反应的离子方程式为MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑,
故答案为:第三周期ⅦA族;MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑;
(2)由上述四种元素中的三种组成的强碱为NaOH,由上述四种元素中的三种组成的某种家用消毒液的有效成分为NaClO,
故答案为:NaOH;NaClO;
(3)由O和Na两种元素组成的一种化合物,其中O和Na的原子个数比为1:1,则对应的化合物为Na2O2,为离子化合物,含有的化学键类型是离子键和共价键;
故答案为:离子键和共价键;
(4)B是次氯酸钠,具有强氧化性,CN-具有还原性,所以次氯酸根离子和CN-能发生氧化还原反应,次氯酸根离子被还原成氯离子,CN-被还原成氮气和碳酸根离子,该反应必须在碱性条件下进行,所以反应物中含有氢氧根离子,则反应的离子方程式为ClO-+CN-+OH-→CO32-+Cl-+N2↑+H2O,
故答案为:ClO-+CN-+OH-→CO32-+Cl-+N2↑+H2O.
| 3 |
| 4 |
(1)W为Cl元素,原子序数为17,原子核外有3个电子层,最外层电子为7,应位于周期表第三周期ⅦA族;实验室用MnO2和浓盐酸在加热条件下制备Cl2,反应的离子方程式为MnO2+4H++2Cl-
| ||
故答案为:第三周期ⅦA族;MnO2+4H++2Cl-
| ||
(2)由上述四种元素中的三种组成的强碱为NaOH,由上述四种元素中的三种组成的某种家用消毒液的有效成分为NaClO,
故答案为:NaOH;NaClO;
(3)由O和Na两种元素组成的一种化合物,其中O和Na的原子个数比为1:1,则对应的化合物为Na2O2,为离子化合物,含有的化学键类型是离子键和共价键;
故答案为:离子键和共价键;
(4)B是次氯酸钠,具有强氧化性,CN-具有还原性,所以次氯酸根离子和CN-能发生氧化还原反应,次氯酸根离子被还原成氯离子,CN-被还原成氮气和碳酸根离子,该反应必须在碱性条件下进行,所以反应物中含有氢氧根离子,则反应的离子方程式为ClO-+CN-+OH-→CO32-+Cl-+N2↑+H2O,
故答案为:ClO-+CN-+OH-→CO32-+Cl-+N2↑+H2O.
点评:本题考查原子结构和元素周期律的关系及应用,题目难度中等,本题注意氯气的实验室制备方法和离子方程式的书写,侧重于考查学生对物质性质的综合应用能力.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A、NA个氯气分子与NA个氢气分子的质量比等于35.5:1 |
| B、在常温常压下,11.2 L氯气含有分子数为0.5 NA |
| C、与7.8 g Na2O2完全反应时,消耗H2O的分子数为0.2 NA |
| D、1 L 0.5 mol?L-1硝酸钡溶液中所含NO3-数为0.5 NA |
下列有关说法正确的是( )
| A、晶体析出规则是晶格能高的晶体最后析出 |
| B、铜型和钾型都是密置层堆积方式 |
| C、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高 |
| D、在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子 |
1 1 |
2 1 |
3 1 |
| A、氢的五种同位素 |
| B、五种氢元素 |
| C、氢的五种原子 |
| D、氢元素的五种不同微粒 |
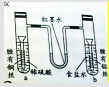 某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )
某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )| A、a、b中负极反应式均是:Fe-2e═Fe2+ |
| B、红墨水柱两边的液面变为左低右高 |
| C、a中铁钉上发生了氧化反应,b中铁钉上发生还原反应 |
| D、a中铜丝附近有气泡产生,b中有白色沉淀产生 |
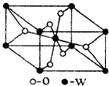 原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.