题目内容
12.某研究性学习小组欲用化学方法测量一个不规则容器的体积.把35.1g NaCl放入 500 mL烧杯中,加入150mL蒸馏水.待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器.从中取出溶液100 mL,该溶液恰好与20mL 0.100mol•L-1 AgNO3溶液完全反应.则该容器的体积为( )| A. | 30 L | B. | 20 L | C. | 10 L | D. | 40 L |
分析 根据Ag++Cl-=AgCl↓计算NaCl溶液的物质的量浓度,根据c=$\frac{n}{V}$计算不规则容器的体积.
解答 解:设100ml溶液中含有xmolNaCl,则
Ag++Cl-=AgCl↓
1mol 1mol
0.02L×0.100mol/L xmol
x=0.002mol,
所以NaCl溶液的物质的量浓度为$\frac{0.002mol}{0.1L}$=0.02mol/L,
35.1g NaCl的物质的量为$\frac{35.1g}{58.5g/mol}$=0.6mol,
设不规则容器的体积为V,
则有:$\frac{0.6mol}{V}$=0.02mol/L,
V=30L,
故选A.
点评 本题考查物质的量浓度的计算,题目难度不大,注意根据反应方程式计算NaCl的物质的量,进而计算物质的量浓度,以此计算容器的体积.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
2.N2H4和N2O4反应生成H2O和N2.若反应消耗1mol N2H4,则下列说法正确的是( )
| A. | 产生33.6L N2 | B. | 被还原的N原子为2mol | ||
| C. | 转移电子为4 mol | D. | 还原产物比氧化产物多0.5mol |
20.在PH=13的无色透明溶液中,能大量共存的离子组为( )
| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | SiO32-、OH-、SO32-、Na+ | D. | MnO4-、Cl-、SO42-、K+ |
1.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:

已知:3NO3-+8Al+5OH-+2H2O═3NH3+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )

已知:3NO3-+8Al+5OH-+2H2O═3NH3+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| C. | 试样中可能存在Na+、Cl- | |
| D. | 试样中一定不含Al3+ |
2.灭鼠灵是一种抗凝血型杀鼠剂,其结构如图.下列叙述不正确的是( )
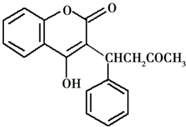

| A. | 灭鼠灵的分子式为C19H17O4 | |
| B. | 灭鼠灵可与溴水发身加成反应 | |
| C. | 分子中所有的碳原子都可能在同一个平面上 | |
| D. | 1 mol灭鼠灵最多可与8 mol H2 反应 |

 、
、 .
. .
. .
.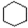 $→_{①}^{Cl_{2}光照}$
$→_{①}^{Cl_{2}光照}$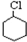 $→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2}不见光}$B$\stackrel{④}{→}$
$→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2}不见光}$B$\stackrel{④}{→}$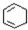 $\stackrel{⑤}{→}$
$\stackrel{⑤}{→}$ $\stackrel{⑥}{→}$C$→_{⑦}^{H_{2}}$
$\stackrel{⑥}{→}$C$→_{⑦}^{H_{2}}$
 ,C
,C .
.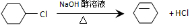 反应⑤
反应⑤ .
.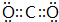 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键. .
.