题目内容
20.在PH=13的无色透明溶液中,能大量共存的离子组为( )| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | SiO32-、OH-、SO32-、Na+ | D. | MnO4-、Cl-、SO42-、K+ |
分析 pH=13,溶液呈碱性,与OH-反应的离子不能大量共存,溶液无色,则有颜色的离子不能大量共存,以此解答该题.
解答 解:A.HCO3-、Al3+发生互促水解,且二者在碱性条件下都不能大量共存,故A错误;
B.碱性条件下,NH4+不能大量共存,故B错误;
C.溶液无色,在碱性条件下,离子之间不发生任何反应,可大量共存,故C正确;
D.MnO4-有颜色,不能大量共存,故D错误.
故选C.
点评 本题考查离子共存问题,为高考常见题型,侧重于学生的分析能力和综合应用化学知识的能力的考查,注意把握离子的性质以及反应类型的判断,注意把握溶液碱性和无色的要求,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列有关Na2CO3和NaHCO3混合溶液的叙述正确的是( )
| A. | 该溶液中,Al3+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 向该溶液中滴入少量NaOH溶液,发生反应的离子方程式:HCO3-+OH-═CO32-+H2O | |
| C. | 该溶液中,Na+、H+、Cl-、NO3-可以大量共存 | |
| D. | 向溶液中滴入过量BaCl2溶液,溶液的pH不变 |
8.下列各有机物中,属于烃的是( )
| A. | 氯丁烷 | B. | 苯 | C. | 硝基苯 | D. | 乙醇 |
15.M2O${\;}_{7}^{x-}$与S2-在酸性溶液中发生如下反应:M2O${\;}_{7}^{x-}$+3S2-+14H+═2M3++3S↓+7H2O,则M2O${\;}_{7}^{x-}$中M的化合价是( )
| A. | +1 | B. | +3 | C. | +4 | D. | +6 |
5.用NA表示阿伏加德罗常数,下列叙述中不正确的是 ( )
| A. | 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA | |
| B. | 高温下,0.2molFe与足量水蒸气反应,转移电子数目为0.6NA | |
| C. | 在过氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.5NA |
12.某研究性学习小组欲用化学方法测量一个不规则容器的体积.把35.1g NaCl放入 500 mL烧杯中,加入150mL蒸馏水.待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器.从中取出溶液100 mL,该溶液恰好与20mL 0.100mol•L-1 AgNO3溶液完全反应.则该容器的体积为( )
| A. | 30 L | B. | 20 L | C. | 10 L | D. | 40 L |
9.如表实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A. | A | B. | B | C. | C | D. | D |
10.下列不能使有色布条褪色的是( )
| A. | 氯水 | B. | 次氯酸钠溶液 | C. | 漂白粉溶液 | D. | 氯化钙溶液 |
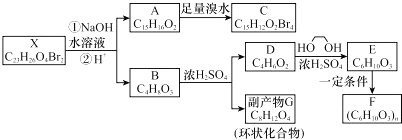
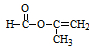 ;
; ;
; .
.