题目内容
11.与氢气反应的热化学方程式是①I2(g)+H2(g)?2HI(g)△H=-9.48KJ•mol-1
②I2(s)+H2(g)?2HI(g)△H=+26.48KJ•mol-1
下列说法正确的是( )
| A. | ①的产物比②的产物稳定 | |
| B. | I2(s)=I2(g)△H=+17.00KJ•mol-1 | |
| C. | ②的反应物总能量比①的反应物总能量低 | |
| D. | 1molI2(g)中通入1molH2(g),发生反应时放热9.48KJ |
分析 热化学方程式的理解问题,并且注意热化学方程式的意义,①是放热反应;②是吸热反应,然后结合盖斯定律进行比较.
解答 解:A.一样稳定,都是HI的气态因为是可逆反应,所以不能进行完全,放热小于9.48kJ,故A错误;
B.由盖斯定律知②-①得,△H=+26.48kJ/mol-(-9.48)kJ/mol=+35.96kJ/mol,故B错误;
C.对于同一物质,固态物质的能量比气态物质能量低;因此反应②的反应物总能量比反应①的反应物总能量低,故C正确;
D.因为是可逆反应,1mol I2(g)中通入1 mol H2(g),发生反应放热小于9.48 kJ,故D错误;
故选C.
点评 本题考查热化学方程式,注意书写及计算,根据题意计算反应热是解题的关键,并注意盖斯定律在计算反应热中的应用来解答.

练习册系列答案
相关题目
12.2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1、CO(g)+O2(g)=CO2(g)△H=-283kJ•mol-1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体的H2和CO的物质的量之比( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
10.在一个容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0.下列各项能说明该反应已经达到平衡状态的是( )
| A. | 容器内气体压强不再改变 | |
| B. | N2和H2的物质的量不变且比例为1:3 | |
| C. | 断裂1mol N≡N键的同时,断裂3 mol H-H键 | |
| D. | 反应消耗N2、H2与产生NH3的速率之比1:3:2 |
16.有机物燃烧时可能产生一定量的黑烟,下列各组有机物在相同的外界条件下燃烧时,产生的黑烟最浓的一组是( )
| A. | CH3-CH2OH和H2 | B. | CH4和CH3CH2CH3 | ||
| C. | CH2═CH2和CH2═CH-CH3 | D. |  和H-C≡C-H 和H-C≡C-H |
20.碱性锌锰电池比酸性锌猛电池性能好,放电电流大,碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,下列有关碱性锌锰电池的说法正确的是( )
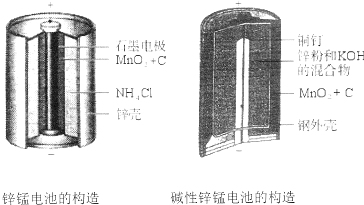

| A. | 该电池反应中二氧化锰起催化作用 | |
| B. | 电池负极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| C. | 当0.1molZn完全反应时,流经电池内部的电子个数为1.204×1023 | |
| D. | 碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大 |
1.下列存放物质的方法中不正确的是( )
| A. | 金属钠保存在煤油中 | |
| B. | 氢氟酸保存在玻璃试剂瓶中 | |
| C. | 漂白粉必须密封保存 | |
| D. | 氢氧化钠溶液保存在带橡胶塞的试剂瓶中 |




 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: