题目内容
8.标准状况下有如下气体:①6.72LCH4②3.01×1023个HCl分子 ③13.6gH2S ④0.2molNH3下列对这四种气体的关系排列的组合中正确的是( )| A. | 体积:②>③ | B. | 密度:④>① | C. | 质量:③>① | D. | 氢原子个数:①>② |
分析 根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$计算,相同条件下,气体的密度与摩尔质量成正比,结合分子的构成分析解答.
解答 解:①6.72L CH4 物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,
②3.01×1023个HCl分子的物质的量为0.5mol,
③13.6g H2S 的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,
④0.2mol NH3.
A.相同条件下,气体的体积之比等于物质的量之比,所以体积体积②>③,故A正确;
B.各物质的摩尔质量分别为①CH4 为16g/mol②HCl为36.5g/mol ③H2S 为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度④>①,故B正确;
C.各物质的质量分别为①CH4 为0.3mol×16g/mol=4.8g,②HCl为0.5mol×36.5g/mol=18.25g,③H2S 13.6g,④NH3为0.2mol×17g/mol=3.4g,所以质量③>①,故C正确;
D.各物质中H原子的物质的量分别为①CH4 为0.3mol×4=1.2mol②HCl为0.5mol,所以氢原子个数①>②,故D正确;
故选ABCD.
点评 本题考查物质的量的有关计算,内容涉及常用化学计量有关计算、阿伏伽德罗定律及推论,难度不大,旨在考查学生对基础知识的掌握.

练习册系列答案
相关题目
10.在一个容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0.下列各项能说明该反应已经达到平衡状态的是( )
| A. | 容器内气体压强不再改变 | |
| B. | N2和H2的物质的量不变且比例为1:3 | |
| C. | 断裂1mol N≡N键的同时,断裂3 mol H-H键 | |
| D. | 反应消耗N2、H2与产生NH3的速率之比1:3:2 |
16.有机物燃烧时可能产生一定量的黑烟,下列各组有机物在相同的外界条件下燃烧时,产生的黑烟最浓的一组是( )
| A. | CH3-CH2OH和H2 | B. | CH4和CH3CH2CH3 | ||
| C. | CH2═CH2和CH2═CH-CH3 | D. |  和H-C≡C-H 和H-C≡C-H |
13.下列做法不能体现低碳生活的是( )
| A. | 注意节约用水 | B. | 减少食品加工过程 | ||
| C. | 发展氢能和太阳能 | D. | 大量使用化石燃料 |
20.碱性锌锰电池比酸性锌猛电池性能好,放电电流大,碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,下列有关碱性锌锰电池的说法正确的是( )
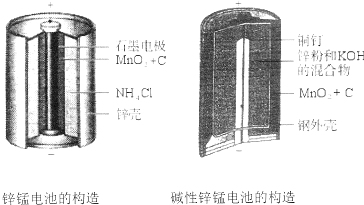

| A. | 该电池反应中二氧化锰起催化作用 | |
| B. | 电池负极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| C. | 当0.1molZn完全反应时,流经电池内部的电子个数为1.204×1023 | |
| D. | 碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大 |
17.利用如图所示装置可以将温室气体CO2转化为燃料气体CO.下列说法中,正确的是( )

| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | 电极a表面发生还原反应 | |
| C. | 该装置工作时,H+从b极区向a极区移动 | |
| D. | 该装置中每生成1 mol CO,同时生成1 mol O2 |
18.下列说法不正确的是( )
| A. | 俄国化学家门捷列夫于1869年发表了第一张元素周期表 | |
| B. | 现代化学常利用原子光谱的特征谱线来测定分子的结构 | |
| C. | DNA双螺旋的两个螺旋链是用氢键相结合的 | |
| D. | 区分晶体和非晶体最可靠的科学方法是X-射线衍射实验 |
