题目内容
19.pH与体积都相同的硫酸和醋酸溶液,分别与同物质的量浓度、同体积的Na2CO3溶液反应,若在相同条件下放出CO2的量相同,则下列推断合理的是( )| A. | Na2CO3过量 | B. | Na2CO3恰好与醋酸完全反应 | ||
| C. | 两种酸都过量 | D. | 两种酸的物质的量浓度相同 |
分析 依据硫酸和醋酸溶液的pH与体积都相同,通过比较两种酸中最终能电离出H+物质的量的大小和相同条件下放出CO2的量相同来解答.
解答 解:A、若碳酸钠过量,pH与体积都相同的硫酸和醋酸溶液,因为醋酸是弱酸存在电离平衡,所以醋酸反应生成的二氧化碳要比硫酸多,故A错误;
B、若Na2CO3恰好与醋酸完全反应,由于硫酸和醋酸溶液pH与体积都相同,醋酸存在电离平衡,平衡状态下的氢离子与硫酸溶液中的氢离子相同,反应后醋酸又电离出氢离子,所以放出二氧化碳气体的量醋酸比硫酸多,故B错误;
C、若两种酸都过量,同量的碳酸钠全部反应生成二氧化碳气的量相同,故C正确;
C、两种酸的物质的量浓度相同,醋酸是弱酸电离产生的氢离子少于硫酸,故pH不相同,故D错误;
故选:C.
点评 本题考查了弱电解质的电离平衡的应用,强弱电解质与等量物质反应时物质的量的判断,注意弱酸存在电离平衡,反应过程中会继续电离.

练习册系列答案
相关题目
10.某有机物结构如图,它不可能具有的性质是( )


| A. | 能跟KOH溶液反应 | B. | 能被氧化 | C. | 能发生加聚反应 | D. | 能使溴水褪色 |
7.将Na2O2与过量NaHCO3混合固体在密闭容器中充分加热反应后,排出气体后最终剩余固体是( )
| A. | NaOH和Na2O2 | B. | NaOH和Na2CO3 | C. | Na2CO3 | D. | Na2O2 |
14.黄酒酿造过程中有部分乙醇最终转化为具有芳香气味的物质,该过程中发生的反应有( )
| A. | 还原反应 | B. | 氧化反应 | C. | 加成反应 | D. | 聚合反应 |
8.下列有关试剂保持或实验操作的叙述正确的是( )
| A. | 浓硝酸保存在棕色橡胶塞的试剂瓶中 | |
| B. | 用溴的四氯化碳溶液除去甲烷中的乙烯杂质 | |
| C. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| D. | 配制NH4Fe(SO4)2标准溶液时,加入一定量HCl以防水解 |
9.同温同压下,将四个容积相同的干燥圆底烧瓶中分别充满①NH3、②NO2、③混有空气的NH3、④混有空气的NO2进行喷泉实验.最后烧瓶内溶液的物质的量浓度(假设烧瓶内溶液不扩散)大小关系是( )
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ④>①=②=③ |
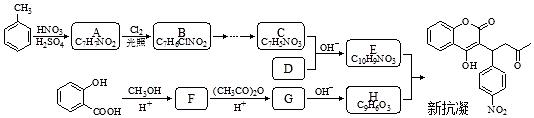
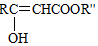
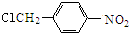 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$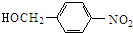 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$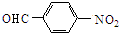 .
. ,名称是乙烯.
,名称是乙烯. ,名称是聚乙烯.
,名称是聚乙烯.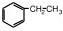 、
、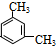 .
. .属于取代反应反应类型.
.属于取代反应反应类型.