题目内容
14.地壳中含量最高的金属是铝,NaHCO3俗称小苏打,制造计算机芯片的半导体材料是硅,水晶项链的主要成分是SiO2.分析 根据地壳中含量顺序为O,Si,Al,Fe,Ca,NaHCO3俗称小苏打,以及物质的用途来解答.
解答 解:地壳中含量顺序为O,Si,Al,Fe,Ca,所以最高的金属是铝,NaHCO3俗称小苏打,制造计算机芯片的半导体材料是硅,水晶项链的主要成分是SiO2;
故答案为:铝;小苏打;硅;SiO2.
点评 本题考查物质的基本用途以及硅及二氧化硅,侧重于学生的记忆能力的考查,注意从元素化合价的角度认识相关概念和物质的性质,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列物质之间的转化都能一步实现的是( )
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Al→Al2O3→Al(OH)3→NaAl(OH)4 | ||
| C. | N2→NH3→NO→NO2→HNO3→NO2 | D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
5.下列两种物质,不需要加热就能反应生成气体的是( )
| A. | Cu+H2SO4(浓) | B. | Cu+HNO3(浓) | C. | Fe+H2SO4(浓) | D. | C+H2SO4(浓) |
2.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”或“>”).
(2)0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”或“>”).
(2)0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
9.下列叙述正确的是( )
| A. | O2的相对分子质量为32 | |
| B. | 1molCO2的质量为44g/mol | |
| C. | H2SO4的摩尔质量为98 | |
| D. | 标准状况下,气体摩尔体积约为22.4L |
19.下列说法正确的是( )
| A. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 物质发生化学反应时不一定都伴随着能量变化 |
6.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )
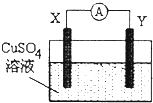

| A. | 若X为Fe,Y为Cu,则铁为正极 | |
| B. | 若X为Ag,Y为Cu,则电流表的指针不发生偏转 | |
| C. | 若X为Cu,Y为Zn,则锌片发生还原反应 | |
| D. | 若X为Fe,Y为C,则碳棒上有红色固体析出 |
3.下列化学用语表示正确的是( )
| A. | 乙烯的结构简式:C2H4 | |
| B. | HCl的电子式: | |
| C. | CH3COOH官能团名称:羟基 | |
| D. | 氨水的电离方程式:NH3•H2O?NH${\;}_{4}^{+}$+OH- |
4.下列物质性质与应用对应关系不正确的是( )
| A. | SO2有漂白性,工业上常用它来漂白纸浆 | |
| B. | 单质硅具有半导体性能,可以制成光电池 | |
| C. | Fe2O3是一种红棕色粉末,常用作红色油漆 | |
| D. | 明矾在天然水中生成Al(OH)3胶体,可用作自来水的消毒剂 |