题目内容
6.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )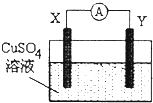
| A. | 若X为Fe,Y为Cu,则铁为正极 | |
| B. | 若X为Ag,Y为Cu,则电流表的指针不发生偏转 | |
| C. | 若X为Cu,Y为Zn,则锌片发生还原反应 | |
| D. | 若X为Fe,Y为C,则碳棒上有红色固体析出 |
分析 A、若X为Fe,Y为Cu,此时活泼金属作负极;
B、在原电池中会产生电流,注意金属的吸氧腐蚀原理;
C、Zn比Cu活泼,Zn作负极发生氧化反应;
D、若X为Fe,Y为C,电解质溶液为硫酸铜,则正极C上析出Cu.
解答 解:A、Fe比Cu活泼,Fe作负极,故A错误;
B、若X为Ag,Y为Cu,则会发生金属的吸氧腐蚀,会产生电流,故B错误;
C、Zn比Cu活泼,Zn作负极发生氧化反应,故C错误;
D、若X为Fe,Y为C,电解质溶液为硫酸铜,则正极C上析出Cu,故D正确;
故选D.
点评 本题考查了原电池原理,注意活泼金属作负极发生氧化反应,电子由负极经外电路流向正极,题目难度不大.

练习册系列答案
相关题目
16.将纯锌片和纯铜片按图所示方式插入稀硫酸中一段时间,以下叙述正确的是( )


| A. | 铜片表面发生氧化反应 | B. | 电子从铜片流向锌片 | ||
| C. | 电流从锌片流向铜片 | D. | 锌片为负极铜片为正极 |
17.已知0.1mol/L的醋酸溶液中存在如下电离平衡CH3COOH?CH3COO-+H+,并测得其在t℃时Ka=b,下列说法中正确的是( )
| A. | 增大c(CH3COOH),b增大 | B. | 加水稀释,b减小 | ||
| C. | b的大小只与温度有关 | D. | 以上说法均不对 |
1.用惰性电极电解2mol•L-1下列物质的溶液,电解前后溶液的pH保持不变的是( )
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
18.下列气体适合用排水法收集但不适合用排空气法收集的是( )
| A. | NH3 | B. | HC1 | C. | S02 | D. | NO |
16.下列生产过程中不涉及氧化还原反应的是( )
| A. | 用铁矿石炼铁 | B. | 接触法生产硫酸 | ||
| C. | 侯氏制碱法制纯碱 | D. | 用胆矾炼铜 |
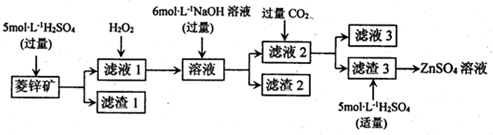
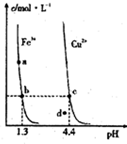 ②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.
②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.