题目内容
4.下列物质性质与应用对应关系不正确的是( )| A. | SO2有漂白性,工业上常用它来漂白纸浆 | |
| B. | 单质硅具有半导体性能,可以制成光电池 | |
| C. | Fe2O3是一种红棕色粉末,常用作红色油漆 | |
| D. | 明矾在天然水中生成Al(OH)3胶体,可用作自来水的消毒剂 |
分析 A、二氧化硫具有漂白性,其漂白原理是能和某些有色物质反应生成无色物质;
B、硅是半导体材料;
C、Fe2O3为红色物质,可作油漆涂料;
D、明矾只净水,不消毒.
解答 解:A、二氧化硫具有漂白性,其漂白原理是能和某些有色物质反应生成无色物质,所以利用二氧化硫漂白纸浆,故A正确;
B、硅是半导体材料,可用于制光电池,故B正确;
C、Fe2O3为红色物质,则常用作红色油漆和涂料,故C正确;
D、明矾只净水,不消毒,故D错误;
故选D.
点评 本题考查物质的性质、用途的关系,明确物质的性质是解答的关键,注意性质决定物质的用途,并把握化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
12.如表中实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 向苯和苯酚混合溶液中滴加过量浓溴水 | 除去混合溶液中的苯酚 |
| B | 向待测液中加入饱和碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3mL5%CuSO4溶液中滴加3-4滴1%氢氧化钠溶液,再向其中加入0.5mL乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
16.下列生产过程中不涉及氧化还原反应的是( )
| A. | 用铁矿石炼铁 | B. | 接触法生产硫酸 | ||
| C. | 侯氏制碱法制纯碱 | D. | 用胆矾炼铜 |
13.有机物分子式为C6H12O2,它能和氢氧化钠溶液发生中和反应.它的分子中含有2个甲基、3个甲基的同分异构体分别有( )
| A. | 4种、3种 | B. | 3种、4种 | C. | 6种、2种 | D. | 2种、6种 |
4.下列电子构型的原子中,第二电离能与第一电离能差值最大的是( )
| A. | 1s22s22p5 | B. | 1s22s22p2 | C. | 1s22s22p63s1 | D. | 1s22s22p63s2 |
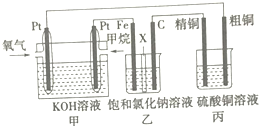 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: