题目内容
9.下列叙述正确的是( )| A. | O2的相对分子质量为32 | |
| B. | 1molCO2的质量为44g/mol | |
| C. | H2SO4的摩尔质量为98 | |
| D. | 标准状况下,气体摩尔体积约为22.4L |
分析 A.O2的相对分子质量为16×2;
B.1molCO2的质量为44g;
C.H2SO4的摩尔质量为98/mol;
D.标准状况下,气体摩尔体积约为22.4L/mol.
解答 解:A.O2的相对分子质量为16×2=32,故A正确;
B.1molCO2的质量为44g,g/mol是摩尔质量的单位,故B错误;
C.H2SO4的摩尔质量为98/mol,故C错误;
D.标准状况下,气体摩尔体积约为22.4L/mol,故D错误;
故选A.
点评 本题考查了质量、摩尔质量、气体摩尔体积,难度不大,掌握基本概念的定义和单位是解题关键.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
19.自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是( )
| A. | 原生铜的硫化物具有还原性 | |
| B. | 常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 | |
| C. | 铜蓝的形成过程是:ZnS(S)+Cu2+?CuS(S)+Zn2+ | |
| D. | 硝酸型酸雨不利于铜蓝的形成:CuS+2H+═Cu2++H2S↑ |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
17.已知0.1mol/L的醋酸溶液中存在如下电离平衡CH3COOH?CH3COO-+H+,并测得其在t℃时Ka=b,下列说法中正确的是( )
| A. | 增大c(CH3COOH),b增大 | B. | 加水稀释,b减小 | ||
| C. | b的大小只与温度有关 | D. | 以上说法均不对 |
4.传感器可以检测空气中SO2的含量,传感器工作原理如图所示.下列叙述正确的是( )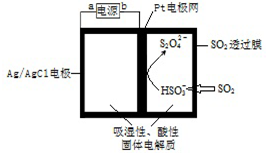

| A. | 阴极发生氧化反应 | |
| B. | 当电路中电子转移为5×10-5mol时,进入传感器的SO2为 1.12 mL | |
| C. | 正极反应式 Ag-e-=Ag+ | |
| D. | b为电源的负极 |
1.用惰性电极电解2mol•L-1下列物质的溶液,电解前后溶液的pH保持不变的是( )
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
18.下列气体适合用排水法收集但不适合用排空气法收集的是( )
| A. | NH3 | B. | HC1 | C. | S02 | D. | NO |
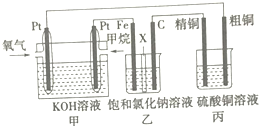 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: