题目内容
9.下列性质比较中不正确的是( )| A. | 沸点:CBr4>CF4 | B. | 水溶性:HBr>Br2 | ||
| C. | 硬度:镁>镁铝合金 | D. | 熔点:金刚石>NaCl |
分析 A.对于分子晶体,相对分子质量越大,范德华力越大,沸点越高;
B.水是极性分子,HBr是极性分子,Br2是非极性分子;
C.镁铝合金的硬度比镁的硬度大;
D.原子晶体的熔点大于离子晶体.
解答 解:A.CBr4和CF4都是分子晶体,CBr4的相对分子质量大于CF4,范德华力越大,沸点越高,因此沸点CBr4>CF4,故A正确;
B.水是极性分子,HBr是极性分子,Br2是非极性分子,根据相似相溶,水溶性HBr>Br2,故B正确;
C.镁铝合金的硬度比镁的硬度大,故C错误;
D.金刚石是原子晶体,NaCl是离子晶体,原子晶体的熔点大于离子晶体,因此熔点:金刚石>NaCl,故D正确;
故选C.
点评 本题主要考查元素性质的变化规律,为高频考点,涉及晶体类型、合金的性质、相似相溶原理,掌握化学规律即可完成,题目难度中等.

练习册系列答案
相关题目
19.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L | |
| B. | 标况下,22.4L空气中含有NA个单质分子 | |
| C. | 1molCl2参加反应转移电子数一定为2NA | |
| D. | 在18g18O2中含有10NA个中子 |
20.下列反应中,属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+CO2↑+H2O | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
17.下列关于原电池和电解池的有关说法正确的是( )
| A. | 原电池的负极发生氧化反应,原电池在工作时负极一定溶解 | |
| B. | 以KOH溶液为电解质溶液的甲烷燃料电池工作时,OH-离子从正极移向负极,电解质溶液的PH增大 | |
| C. | 以两个铜棒为电极电解硫酸溶液,在阴极上发生还原反应,且始终是H+在阴极放电生成H2 | |
| D. | 反应2Ag+2HCl═2AgCl+H2↑在电解的条件下可以发生 |
4.下列有关比较中正确的是( )
| A. | 第一电离能:P>S | B. | 气态氢化物的稳定性:CH4>NH3 | ||
| C. | 电负性:CI>F | D. | 最高正化合价:F>S |
14.下列有关Al(NO3)3溶液的叙述正确的是( )
| A. | 该溶液中H+、Fe2+、SO42-、Cl-可以大量共存 | |
| B. | 向该溶液中通入SO2气体不会发生反应 | |
| C. | 向该溶液中加入过量氨水发生反应的离子方程式Al3++4NH3•H2O═AlO2-+4NH4++2H2O: | |
| D. | 向该溶液中滴入Na2CO3溶液发生反应的离子方程式:2Al3++3CO32-+3 H2O═2Al(OH)3↓+3CO2↑ |
1.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 二氧化硅是人类将太阳能转换为电能的常用材料 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应水化物的酸性比W的弱 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | W的气态简单氢化物的热稳定性比Y的强 |
19.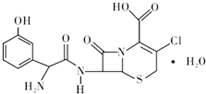 头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
 头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )| A. | 其分子式可以表示为C15H16ClN3O6S | |
| B. | 该物质具有两性 | |
| C. | 1 mol该化合物与NaOH溶液作用时消耗NaOH的物质的量最多为 4 mol | |
| D. | 该物质遇FeCl3溶液显紫色 |