题目内容
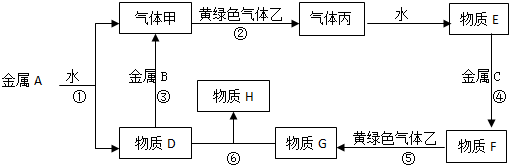
17.下列关于原电池和电解池的有关说法正确的是( )| A. | 原电池的负极发生氧化反应,原电池在工作时负极一定溶解 | |
| B. | 以KOH溶液为电解质溶液的甲烷燃料电池工作时,OH-离子从正极移向负极,电解质溶液的PH增大 | |
| C. | 以两个铜棒为电极电解硫酸溶液,在阴极上发生还原反应,且始终是H+在阴极放电生成H2 | |
| D. | 反应2Ag+2HCl═2AgCl+H2↑在电解的条件下可以发生 |
分析 A.燃料电池的电极不溶解;
B.生成水,溶液浓度减小,电解质溶液的pH减小;
C.电解后期在阴极上放电的是Cu2+;
D.以银为阳极以盐酸为电解质溶液进行电解就可以实现.
解答 解:A.燃料电池的电极不溶解,故A错误;
B.以KOH溶液为电解质溶液的甲烷燃料电池工作时,生成水,溶液浓度减小,电解质溶液的pH减小,故B错误;
C.电解后期在阴极上放电的是Cu2+,故C错误;
D.原电池反应是自发进行的,非自发进行的反应可以通过电解来实现,该反应以银为阳极以盐酸为电解质溶液进行电解就可以实现,故D正确.
故选D.
点评 本题考查原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,正确判断原电池和电解池及其正负极和阴阳极是解本题关键,难度不大.

练习册系列答案
相关题目
5.下列实验操作中错误的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 过滤操作时,应用玻璃棒作引流 |
12.如图所示,6个编号分别代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁).图中⑤表示的物质是( )
a.Al b.Fe2O3 c.NaOH 溶液 d.Cl2 e.NH3 f.氢碘酸溶液.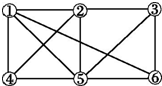
a.Al b.Fe2O3 c.NaOH 溶液 d.Cl2 e.NH3 f.氢碘酸溶液.

| A. | a 或b | B. | c | C. | d 或e | D. | f |
2.下列生活中的事实与“温度对化学反应速率影响”有关的是( )
| A. | 夏天的食物比冬天的食物腐败变质更快 | |
| B. | 锅炉房里粉末状的煤比块状的煤燃烧得更快更旺 | |
| C. | 汽车加大油门跑得更快 | |
| D. | 充满N2的塑料密封袋保存的薯片保质期更长 |
9.下列性质比较中不正确的是( )
| A. | 沸点:CBr4>CF4 | B. | 水溶性:HBr>Br2 | ||
| C. | 硬度:镁>镁铝合金 | D. | 熔点:金刚石>NaCl |
6.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下18g铝放入足量浓硫酸中转移电子数2NA | |
| B. | 0.1mol/L的稀硫酸中含有H+个数为0.2NA | |
| C. | 27g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA | |
| D. | 标准状况下,22.4LCCl4所含分子数为NA |
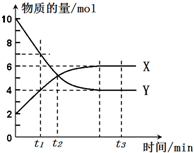 一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.
一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.