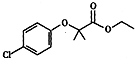
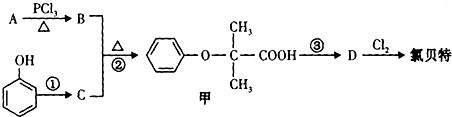
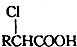��Ŀ����
14���мס��ҡ��������������ֶ�����Ԫ�أ�ԭ���������������䳣�����ϼ�����Ϊ+1��-2��+1��+3��-1�������γɵ����ʼ��ת����ϵ��ͼ1��ʾ���������ö��Ե缫��⣨�������ӽ���Ĥ��1L l mol��/L��A��Һ��
�밴Ҫ��ش��������⣺
��1����Ԫ�����Ԫ��ͬ���壬�ȱ�ԭ�Ӷ�2�����Ӳ㣬��ԭ������Ϊ37���Ʋ���ͬ�����±��������ʷֱ���ˮ��Ӧ���ҳ̶ȵ�������ͬ����Ԫ�صĽ�������˵���������Ӷ���ǿ���Ʋ⼺������ˮ��Ӧ�ϱ������ң�
��2���ס��ҡ��찴ԭ�������1��1��1�γɵĻ�����Y����Ư���ԣ������ʽΪ
 ��
����3����ͼת����ϵ�в�����������ԭ��Ӧ���У����ţ��ܣ�
��4����ͨͼ2��·Ƭ�̺����ձ��еμ�һ���Լ����ɼ������缫����ʴ���˷�Ӧ�����ӷ���ʽΪ3Fe2++2[Fe��CN��6]3-=Fe3[Fe��CN��6]2����
��5������Ӧ�ٵ��һ��ʱ�����D��ҺpH=12�������£�����������ȫ�ݳ���ȡ������Ĥ����Һ��ֻ��ȣ�������Һ����仯������ʱ��ת�Ƶ�����ĿԼΪ6.02��l021����Ӧ�ڵ����ӷ���ʽΪ2A1+2OH-+2H2O=2AlO2-+3H2����
��6����ͼ1�и�����Ӧ��Ϊǡ����ȫת����������X�к��е����ʣ���ˮ�⣩��Al ��OH��3��NaCl��
���� ���A����Һ�õ��������ʣ�����ʼ�ˮ�Էŵ磬�õ�����ɫ����BΪCl2������CΪH2�����߷�Ӧ����EΪHCl��DΪ�������+3�ۣ�������D��Һ��Ӧ������������ΪAl��DΪNaOH��FΪNaAlO2��AΪNaCl����ⷴӦΪ2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2������2Al��2NaOH��2NaAlO2���õ�ƫ��������HCl���ʵ���֮��Ϊ1��1����H2O+HCl+NaAlO2�TNaCl+Al ��OH��3������X�к��е�����ΪAl ��OH��3��H2O��NaCl�����Ԫ�ػ��ϼ���ԭ��������֪����ΪHԪ�أ���ΪOԪ�أ���ΪNa����ΪAl����ΪCl��
��� �⣺���A����Һ�õ��������ʣ�����ʼ�ˮ�Էŵ磬�õ�����ɫ����BΪCl2������CΪH2�����߷�Ӧ����EΪHCl��DΪ�������+3�ۣ�������D��Һ��Ӧ������������ΪAl��DΪNaOH��FΪNaAlO2��AΪNaCl����ⷴӦΪ2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2������2Al��2NaOH��2NaAlO2���õ�ƫ��������HCl���ʵ���֮��Ϊ1��1����H2O+HCl+NaAlO2�TNaCl+Al ��OH��3������X�к��е�����ΪAl ��OH��3��H2O��NaCl�����Ԫ�ػ��ϼ���ԭ��������֪����ΪHԪ�أ���ΪOԪ�أ���ΪNa����ΪAl����ΪCl��
��1����Ԫ�������Na��Ԫ��ͬ���壬�ȱ�ԭ�Ӷ�2�����Ӳ㣬��ԭ������Ϊ11+8+18=37��ͬ����Ԫ�صĽ�������˵���������Ӷ���ǿ���Ʋ⼺������ˮ��Ӧ�ϱ������ң�
�ʴ�Ϊ��37��ͬ����Ԫ�صĽ�������˵���������Ӷ���ǿ���Ʋ⼺������ˮ��Ӧ�ϱ������ң�
��2���ס��ҡ��찴ԭ�������1��1��1�γɵĻ�����Y����Ư���ԣ�YΪHClO�������ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��3����ͼת����ϵ�У���Ӧ�٢ڢ�����������ԭ��Ӧ����Ӧ�ܲ�����������ԭ��Ӧ��
�ʴ�Ϊ���ܣ�
��4����ͨͼ2��·Ƭ�̺�
FeΪ�������������ҺΪ�Ȼ�����Һ������������ʴ����Fe2+���ӣ���K3[Fe��CN��6]���飬����Fe2+�����ӷ���ʽΪ��3Fe2++2[Fe��CN��6]3-=Fe3[Fe��CN��6]2����
�ʴ�Ϊ��3Fe2++2[Fe��CN��6]3-=Fe3[Fe��CN��6]2����
��5����Ӧ��Ϊ2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2�������һ��ʱ�����D��ҺpH=12����NaOHΪ0.01mol/L��������������Ϊ1L��0.01mol/L=0.01mol��ת�Ƶ���Ϊ0.01mol����ʱ��ת�Ƶ�����ĿԼΪ0.01mol��6.02��l023mol-1=6.02��l021����Ӧ�ڵ����ӷ���ʽΪ��2A1+2OH-+2H2O=2AlO2-+3H2����
�ʴ�Ϊ��6.02��l021��2A1+2OH-+2H2O=2AlO2-+3H2����
��6��X�к��е�����ΪAl ��OH��3��H2O��NaCl��
�ʴ�Ϊ��Al ��OH��3��NaCl��
���� ���⿼�������ƶϣ�ע��ץס������Ԫ���γɵ����ʣ����ݵ�ⷴӦ�����ʵ���ɫ��Ϊͻ�ƿڽ����ƶϣ���Ҫѧ���߱���ʵ�Ļ�����

 ��������
��������| A�� | ��ͬ�¶��µ�ƽ�ⳣ��K3��K4��K5 | |
| B�� | ����Ӧ���ʣ�vB=vD | |
| C�� | ����ϵ�����ƽ����Է����������ٸı�ʱ������˵����Ӧ�ﵽƽ��״̬ | |
| D�� | A��B��D��E���δ�ﵽƽ��״̬��C��ﵽƽ��״̬ |
| A�� | 1L1mol•L-1��NaClO��Һ�к���ClO-����ĿΪNA | |
| B�� | 78g������C=C˫������ĿΪ3NA | |
| C�� | ���³�ѹ�£�14g��N2��CO��ɵĻ�����庬�е�ԭ����ĿΪNA | |
| D�� | 6.72L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.2NA |
| A�� | ���ԭ�������͵����� | B�� | ���Ӳ��������������� | ||
| C�� | ���Ӳ����ʹ��������� | D�� | ���ԭ������������������ |
| A�� | �Ȳ������ʵĴ���ˮ�Ⱥȿ�Ȫˮ�������Ӫ���������� | |
| B�� | ά����C���н�ǿ��ԭ�ԣ���������߲�ά����C��ʧС | |
| C�� | ������Һ��������ͭ��Һ����ʯ�Һ�ˮ�Ƶã������ڷ���ֲ��IJ��溦 | |
| D�� | �������ƾ���ǿ��ԭ�Զ�ʹ���ʱ�䱣���ʺ죬��������ʳƷ���˶�� |
| A�� | �����������е���Ԫ�أ�ˮ������������ữ | |
| B�� | Ϊ����ǿKMnO4��Һ��������������Ũ�����ữ | |
| C�� | Ϊ������Fe2+��ˮ�⣬��ϡ�����ữ | |
| D�� | ������Һ���Ƿ���SO42-ʱ�����������ữ |
| A�� | ��������H2SO4�ĵ��뷽��ʽ��H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B�� | H2SO4�ı�������Һ�У�c��CH3COOH2+��=c��HSO4-��+2c��SO42-��+c��CH3COO-�� | |
| C�� | Ũ�Ⱦ�Ϊ0.1mol•L-1��H2SO4��HNO3�ı�������Һ��pH��H2SO4����pH��HNO3�� | |
| D�� | ��HNO3�ı�������Һ�м�������ᣬ$\frac{c��C{H}_{3}COO{{H}_{2}}^{+}��}{c��HN{O}_{3}��}$��С |
| A�� | ��״���£�33.6 L�������к��з�ԭ�ӵ���ĿΪ1.5NA | |
| B�� | ���³�ѹ�£�Na2O2������H2O��Ӧ��������0.2 mol O2��ת�Ƶ�����ĿΪ0.4NA | |
| C�� | 1 L 1 mol?•L-1 FeCl3��ȫˮ������NA���������� | |
| D�� | ��2 mol H2SO4��Ũ������������ͭƬ�ڼ�����������ȫ��Ӧ���ɲ���NA��SO2������� |