题目内容
4.向容积相同的五个密闭容器中,分别充入等物质的量NH3和HCl,在不同温度下,任其发生反应NH3(g)+HCl(g)?NH3Cl(s),并在相同时间测定NH4Cl的质量,如图.下列说法正确的是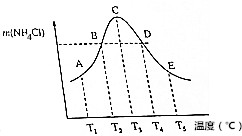 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
分析 在容积相同的不同密闭容器内,分别充入等物质的量NH3和HCl,反应相同时间内,达到平衡状态之前,温度越高,反应速率越大,生成NH4Cl的质量增大,达到平衡后,升高温度,NH4Cl的质量减小,说平衡向逆反应方向移动,故该反应是放热反应.在图中转折点C为平衡状态,转折点左侧(A、B)为平衡状态之前,右侧(D、E)为平衡移动到达新的平衡状态.
解答 解:在容积相同的不同密闭容器内,分别充入等物质的量NH3和HCl,反应相同时间内,达到平衡状态之前,温度越高,反应速率越大,生成NH4Cl的质量增大,达到平衡后,升高温度,NH4Cl的质量减小,说平衡向逆反应方向移动,故该反应是放热反应.在图中转折点C为平衡状态,转折点左侧(A、B)为平衡状态之前,右侧(D、E)为平衡移动到达新的平衡状态.
A.升高温度,平衡逆向移动,平衡常数减小,则平衡常数平衡常数K3>K4>K5,故A错误;
B.单位时间内生成氯化铵的质量相等,则正反应速率:vB=vD,故B正确;
C.平衡混合气体中只有氨气与HCl,二者起始物质的量之比为1:1,且按物质的量1:1反应,二者物质的量之比始终为1:1,气体的平均相对分子质量始终不变,故C错误;
D.A、B未到达平衡,C点达到平衡状态,D、E点达到平衡状态,故D错误.
故选:B.
点评 本题考查化学平衡图象、化学反应速率和化学平衡的影响因素,难度中等,关键是判断C点是平衡点.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
15.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 1 molNa2O2和水完全反应,转移电子数为2NA | |
| B. | 0.5 L 0.2 mol•L-1FeCl3溶液中,含Fe3+离子数为0.1 NA | |
| C. | 理论上氢氧燃料电池负极消耗11.2 L标准状况下气体,外线路通过电子数为NA | |
| D. | 常温常压下,28 g乙烯和丙烯混合气体含有的碳原子总数为2.5NA |
12.某校化学兴趣小组为了探究粗铁粒与某浓度硝酸反应,设计了如下探究活动:
探究一:称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁的价态,同学甲设计如下实验:
现有药品和仪器:药品有:0.1 mol/L KSCN溶液,0.1 mol/L KI溶液,0.2 mol/L酸性高锰酸钾溶液,氯水等;器材有:试管和滴管.
(1)请你设计简单实验,探究上述猜想是否正确,填写下列实验报告.
(2)装置乙的作用:验证NO2的存在并除去NO2.
(3)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(4)同学丙对同学乙的实验设计提出了质疑,他认为丙中的现象不足以证明NO存在,稍作改进即可.试回答改进措施:
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L 酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为:1:3.
(已知2NO2+2NaOH═NaNO3+NaNO2+H2O和NO2+NO+2NaOH═2NaNO2+H2O)
探究一:称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁的价态,同学甲设计如下实验:
现有药品和仪器:药品有:0.1 mol/L KSCN溶液,0.1 mol/L KI溶液,0.2 mol/L酸性高锰酸钾溶液,氯水等;器材有:试管和滴管.
(1)请你设计简单实验,探究上述猜想是否正确,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
(3)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(4)同学丙对同学乙的实验设计提出了质疑,他认为丙中的现象不足以证明NO存在,稍作改进即可.试回答改进措施:
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L 酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为:1:3.
(已知2NO2+2NaOH═NaNO3+NaNO2+H2O和NO2+NO+2NaOH═2NaNO2+H2O)
19.设NA为阿伏加罗常数的值,下列说法不正确的是( )
| A. | 常温下,1L0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 7.8gNa2O2中含有的阴、阳离子总数是0.3NA | |
| C. | N2H2分子中各原子的最外层(除H外)均为8电子结构,1molN2H2中有共用电子对数目为3NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜反应,转移电子数小于0.9NA |
9.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是( )
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
16. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3KJ/mol;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{2}(N{O}_{2})•c({O}_{2})}$,已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2.
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3KJ/mol;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2.

 .
.