题目内容
10.0.1mol•L-1的Na2SO3溶液15mL,恰好被1×10-3mol的XO4-离子氧化成Na2SO4,则X在还原产物中的化合价是( )| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 根据n=cV计算出亚硫酸钠溶液中亚硫酸钠的物质的量,亚硫酸钠被氧化成硫酸钠,化合价升高2价;设X被还原后的化合价为+x,XO4-离子中X的化合价为+7,则化合价降低了(7-x)价,根据氧化还原反应中化合价变化相等计算出x即可.
解答 解:亚硫酸钠的物质的量为:n(Na2SO3)=0.1mol/L×0.015L=0.0015mol,
反应中Na2SO3为还原剂,SO32-中的+4价S被氧化为+6价的SO42-,化合价升高:(6-4)=2,化合价升高的物质的量为:0.0015mol×2=0.003mol,
XO4-为氧化剂,X元素化合价为为+7价,XO4-离子的物质的量为1×10-3mol,X的化合价变化为:$\frac{0.003mol}{1×1{0}^{-3}mol}$=3,
X元素化合价降低了3价,即从+7价降到+4价,
故选D.
点评 本题考查学生氧化还原反应中的电子守恒思想的应用知识,题目难度中等,注意氧化还原反应的本质及特征,明确氧化还原反应中化合价升降相等是解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.对实验现象的观察与分析有助于获得化学知识并学会科学探究的方法.下列对实验现象的分析合理的是
( )
( )
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
18.下列关于化学键的叙述正确的是( )
| A. | 单质分子中均存在化学键 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 只有金属元素和非金属元素化合时才能形成离子键 |
2.下列属于纯净物的是( )
| A. | 盐酸 | B. | 氯水 | C. | 液氨 | D. | 漂白粉 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | O2和O3的混合物共16g,其中所含氧原子数为NA | |
| B. | 1.0L 0.1mol/L的AlCl3溶液中含有的铝离子数为0.1NA | |
| C. | 28g乙烯中所含有共用电子对数目为4NA | |
| D. | 1mol金属钠完全转化为Na2O2所转移的电子数目为2NA |
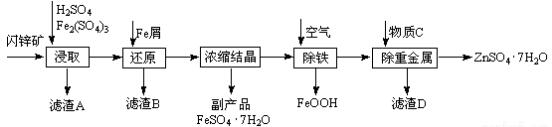
 欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.
欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.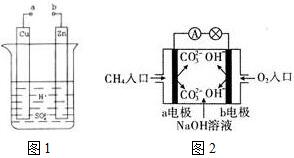 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.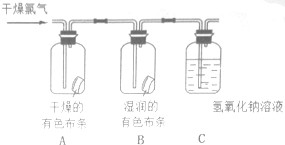 为了验证氯气的有关行政,某同学设计了如下的实验.
为了验证氯气的有关行政,某同学设计了如下的实验.